
【題目】下列有關乙炔的說法不正確的是( )
A.燃燒時有濃厚的黑煙
B.實驗室制乙炔時可用CuSO4除雜質氣體
C.為了減緩電石和水的反應速率,可用飽和食鹽水來代替
D.乙炔的收集方法可用排空氣法收集
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】能正確表示下列反應的離子反應方程式為( )
A. Ba(OH)2溶液中加入少量NaHCO3溶液:HCO3-+Ba2++OH-=BaCO3![]() +H2O
+H2O
B. 向明礬溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:3Ba2++3SO42-+2Al3++6OH-═2BaSO4↓+2Al(OH)3↓
C. NH4HCO3稀溶液與過量的KOH溶液反應:HCO3-+OH-=CO32-+H2O
D. 醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車尾氣凈化器中發生的反應為2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。一定溫度下,在三個體積均為1.0L恒容密閉容器中發生上述反應,測得有關實驗數據如下:
N2(g)+2CO2(g)。一定溫度下,在三個體積均為1.0L恒容密閉容器中發生上述反應,測得有關實驗數據如下:
容器 | 溫度/(℃) | 起始物質的量(mol) | 平衡物質的量(mol) | ||||
NO | CO | N2 | CO2 | N2 | CO2 | ||
I | 400 | 0.2 | 0.2 | 0 | 0 | 0.12 | |
II | 400 | 0.4 | 0.4 | 0 | 0 | ||
III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 | |
下列說法正確是
A. 容器I中達到平衡所需時間2s,則v(N2)=0.06 molL-1·s-1
B. 該反應的ΔS<0、ΔH<0
C. 達到平衡時,體系中c(CO)關系:c(CO,容器II)>2c(CO,容器I)
D. 若起始時向I中充入NO、CO、N2、CO2各0.1mol,開始時V正>V逆
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素周期表中第四周期的金屬元素在生產和科研中有非常重要的使用價值。
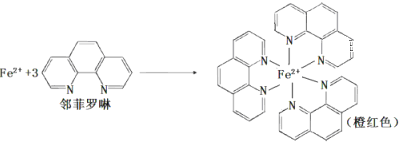
(1)測定土壤中鐵的含量時需先將三價鐵還原為二價鐵,再采用鄰啡羅啉作顯色劑,用比色法測定,若土壤中含有高氯酸鹽時會對測定有干擾。相關的反應如下:
FeCl3+2NH2OHHCl= 4FeCl2+N2O↑+6HCl+H2O
① Fe3+在基態時,核外電子排布式_____;
② 羥胺中(NH2OH)采用sp3雜化的原子有______,三種元素電負性由大到小的順序為______;
③ Fe2+與鄰啡羅啉(用A表示)形成的配合物[FeA3] 2+中,Fe2+的配位數為____;
④N2O分子的空間構型為______(用文字描述)。
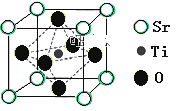
(2)氫的規模化制備是氫能應用的基礎。在光化學電池中,以紫外線照鈦酸鍶電極時,可產生電流。鈦酸鍶晶體結構如圖所示,則鈦酸鍶的化學式為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是一種新型鋰電池裝置,電池充、放電反應為![]()
![]()
![]() 。放電時,需先引發鐵和氯酸鉀反 應使共晶鹽熔化。下列說法不正確的是
。放電時,需先引發鐵和氯酸鉀反 應使共晶鹽熔化。下列說法不正確的是
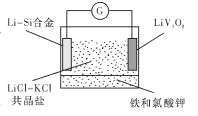
A. 共晶鹽儲熱效果好,利于電解質熔化
B. 整個過程的能量轉化只涉及化學能轉化為電能
C. 放電時LiV3O8電極的反應為xLi++xe-+LiV3O8= Li1+XV3O8
D. 充電時 Cl-移向LiV3O8電極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,用相同物質的量濃度的 HC1 溶液,分別滴定物質的量濃度均為 0.1 mol/L 的三種堿溶液,滴定 曲線如圖所示。下列判斷正確的是

A. 滴定前,三種堿溶液中水電離出的 c(H+)大小關系: DOH>BOH>AOH
B. pH= 7 時,c(A+)=c(B+)=c(D+)
C. 滴定至 P 點時,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
D. 當中和百分數達 100%時,將三種溶液混合后:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素及其化合物在化工、醫藥、材料等領域有著廣泛的應用,回答下列問題:
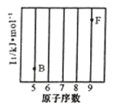
(1)參照下圖 B、F 元素的位置,依據第二周期元素第一電離能的變化規律,用小黑點標出 C、N、O 三 種元素的相對位置。
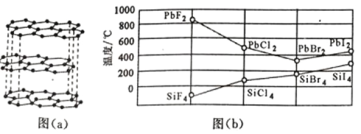
(2)碳的一種單質的結構如圖(a)所示,則碳原子的雜化軌道類型為_________________ 。
(3)二鹵化鉛 PbX2 的熔點如圖(b)所示,可推斷:依 F、Cl、Br、I 次序,PbX2 中的化學鍵 的離子性_____( 填“增 強”、“ 不變”或“減弱”, 下 同 ), 共價性_____。
(4)NH3 和 F2 在 Cu 催化下可發生反應 4NH3+3F2 ![]() NF3+3NH4F,化學方程式中的 5 種物質所屬的晶體 類型有_____(填序號)。寫出基態銅原子的價電子排布式_____。
NF3+3NH4F,化學方程式中的 5 種物質所屬的晶體 類型有_____(填序號)。寫出基態銅原子的價電子排布式_____。
a.離子晶體 b.分子晶體 c.原子晶體 d.金屬晶體
(5)BF3 與一定量水形成(H2O)2·BF3 晶體 Q,Q 在一定條件下可轉化為 R: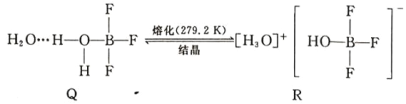 晶體 R 中含有的化學鍵包 括_____。
晶體 R 中含有的化學鍵包 括_____。
(6)水楊酸第一級電離形成離子![]() ,相同溫度下,水楊酸的 Ka2____________________________苯酚
,相同溫度下,水楊酸的 Ka2____________________________苯酚
(![]() )的 Ka(填“>”“ =”或“<”),其原因是______________。
)的 Ka(填“>”“ =”或“<”),其原因是______________。
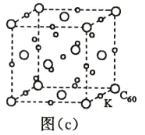
(7)碳的另一種單質 C60 可以與鉀形成低溫超導化合物,晶體結構如圖(c)所示,K 位于立方體的棱上和 立方體的內部,此化合物的化學式為____________;其晶胞參數為 1.4 nm,阿伏加德羅常數用 NA 表 示,則晶體的密度為________________g·cm-3。(只需列出式子)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據表中提供的部分短周期元素原子半徑及主要化合價的信息,回答下列問題
元素代號 | A | B | C | D | E | F | G |
原子半徑/nm | 0.186 | 0.160 | 0.143 | 0.112 | 0.104 | 0.099 | 0.066 |
主要化合價 | +1 | +2 | +3 | +2 | +6、-2 | +7、-1 | -2 |
(1)A在元素周期表中位置是____。
(2)B的離子結構示意圖:_____,
(3)C單質與A的最高價氧化物對應的水化物反應的離子方程式:____。
(4)元素最高價氧化物對應的水化物酸性最強的是:____ (寫化學式)。
(5)A元素與F元素形成的化合物的電子式 _____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】羥甲香豆素是一種治療膽結石的藥物,合成路線如下圖所示:

已知: 
(1)A屬于芳香烴,其結構簡式是______。B中所含的官能團是______。
(2)C→D的反應類型是______。
(3)E屬于酯類。僅以乙醇為有機原料,選用必要的無機試劑合成E,寫出有關化學方程式:______。
(4)已知:![]() 。F所含官能團有
。F所含官能團有![]() 和______。
和______。
(5)以D和F為原料合成羥甲香豆素分為三步反應,寫出有關化合物的結構簡式:
__________________,__________________,__________________,__________________。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com