
分析 發生反應:2Na2O2+2H2O=4NaOH+O2↑,根據方程式計算NaOH、氧氣質量,溶液質量=過氧化鈉質量+水的質量-氧氣質量,進而計算氫氧化鈉的質量分數.
解答 解:反應離子方程式為:2Na2O2+2H2O=4Na++4OH-+O2↑;
設NaOH、氧氣質量分別為x、y,則:
2Na2O2+2H2O=4NaOH+O2↑
2×78 160 32
7.8g x y
所以x=$\frac{7.8g×160}{2×78}$=8g
y=$\frac{7.8g×32}{2×78}$=1.6g
溶液質量為7.8g+93.8g-1.6g=100g,
故溶液中氫氧化鈉質量分數為$\frac{8g}{100g}$=8%,
故答案為:2Na2O2+2H2O=4Na++4OH-+O2↑;8%.
點評 本題考查化學方程式計算、離子方程式書寫,比較基礎,關鍵是計算溶液質量.


 奪冠訓練單元期末沖刺100分系列答案
奪冠訓練單元期末沖刺100分系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗編號 | HA物質的量濃度 (mol•L-1) | NaOH物質的量濃度 (mol•L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | C1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 滴定次數 | 待測溶液的體積/mL | 標準溶液的體積/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2KMnO4+16HCl(濃)═2KCl+2MnCl2+5Cl2↑+8H2O | |
| B. | 2HCl$\frac{\underline{\;通電\;}}{\;}$H2↑+Cl2↑ | |
| C. | HCl+AgNO3═AgCl↓+HNO3 | |
| D. | Zn+2HCl═ZnCl2+H2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酒精、硫酸鋇和水分別屬于電解質、強電解質和弱電解質 | |
| B. | Mg、Al、Cu可以分別用置換法、直接加熱法和電解法冶煉得到 | |
| C. | 硫酸、純堿、醋酸鈉和生石灰分別屬于酸、堿、鹽和氧化物 | |
| D. | 天然氣、沼氣和水煤氣分別屬于化石能源、可再生能源和二次能源 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鹽酸、氨水、水玻璃、漂白粉屬于電解質 | |
| B. | Cl2、SO2均使品紅溶液褪色,但原理不相同 | |
| C. | 同溫同壓下,相同體積的任何氣體都含有相同的原子數 | |
| D. | Na2O2、FeO是堿性氧化物;NO2、SO3是酸性氧化物;Al2O3、SiO2是兩性氧化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
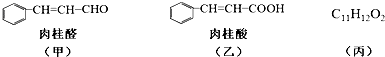
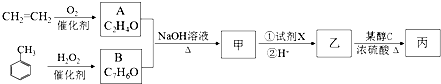
 .
. $→_{△}^{氫氧化鈉溶液}$
$→_{△}^{氫氧化鈉溶液}$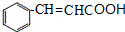 +H2O.
+H2O.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com