
分析 (1)H2O2與亞鐵離子反應生成三價鐵離子;
(2)氫氟酸能與玻璃及陶瓷中的二氧化硅反應;
(3)氫氧化鈉與三價鐵離子反應生成氫氧化鐵,再加HF,生成FeF3和水;
(4)HF屬于有毒的氣體,則制備三氟化鐵時應在通風櫥中進行;
(5)三氟化鐵與Li發生置換反應生成Fe和LiF;
(6)根據C12的物質的量求出亞鐵離子的物質的量,根據氧化鐵的質量求出Fe元素的總物質的量,n(Fe)-n(Fe2+)=n(Fe3+),由亞鐵離子與鐵離子的物質的量之比求出鐵氧體中FeO與Fe2O3的個數比,據此確定鐵氧體的化學式.
解答 解:(1)固體鐵氧體磁性材料溶于過量鹽酸,所得溶液中含有亞鐵離子,接著加入H2O2,H2O2與亞鐵離子反應生成三價鐵離子,其反應的離子方程式為:H2O2+2Fe2++2H+=2Fe3++2H2O,
故答案為:H2O2+2Fe2++2H+=2Fe3++2H2O;
(2)步驟②將沉淀加入反應瓶中,加入過量的氫氟酸溶液反應,由于氫氟酸能與玻璃及陶瓷中的二氧化硅反應,所以反應瓶材質應該為聚四氟乙烯,
故答案為:C;
(3)氫氧化鈉與三價鐵離子反應生成氫氧化鐵,再加HF,生成FeF3和水,則加氫氟酸反生反應的化學方程式為Fe(OH)3+3HF=FeF3+3H2O,
故答案為:Fe(OH)3+3HF=FeF3+3H2O;
(4)HF屬于有毒的氣體,為了防止中毒,則制備三氟化鐵時應在通風櫥中進行,故答案為:通風櫥;
(5)三氟化鐵與Li在固體電解質鐵氧體中發生置換反應生成Fe和LiF,該電池反應的化學方程式為FeF3+3Li=Fe+3LiF,故答案為:FeF3+3Li=Fe+3LiF;
(6)取上述鐵氧體樣品溶于足量鹽酸,在通入標準狀況下672mL C12,則氯氣的物質的量為0.03mol,
由2Fe2++Cl2=2Fe3++2Cl-,可知Fe2+為0.06mol,則原鐵氧體樣品中n(FeO)=0.06mol,
把溶液蒸干,灼燒至恒重得9.6g固體為Fe2O3,則n(Fe2O3)=$\frac{9.6g}{160g/mol}$=0.06mol,則原來溶液中Fe元素共0.06×2=0.12mol,
所以原來溶液中n(Fe3+)=n(Fe)-n(Fe2+)=0.12mol-0.06mol=0.06mol,則原鐵氧體樣品中n(Fe2O3)=0.06mol×$\frac{1}{2}$=0.03,
所以原鐵氧體樣品中n(FeO):n(Fe2O3)=0.06mol:0.03mol=2:1,故鐵氧體的化學式為2FeO•Fe2O3或Fe4O5;
故答案為:2FeO•Fe2O3或Fe4O5.
點評 本題考查了物質制備方案的設計實驗,涉及氧化還原反應、方程式的書寫、物質的量的有關計算、元素化合物的性質等,題目側重于考查學生對基礎知識的綜合應用能力,題目難度中等.


科目:高中化學 來源: 題型:選擇題
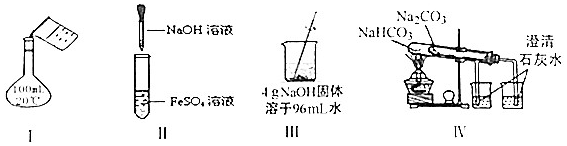
| A. | 實驗Ⅰ:配制150mL0.10mol/L鹽酸 | B. | 實驗II:制取Fe(OH)2 | ||
| C. | 實驗Ⅲ:配制4%NaOH溶液 | D. | 實驗Ⅳ:比較兩種物質的熱穩定性 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,將22.4L氯化氫溶于足量水中,溶液中含有的HCl分子數為NA | |
| B. | 常溫常壓下,16g14CH4所含中子數目為8NA | |
| C. | 常溫常壓下,Na2O2與足量H2O反應,共生成0.2molO2,轉移電子的數目為0.4NA | |
| D. | 標準狀況下,2.24 L己烷含有分子的數目為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酒精燈不慎碰到起火,立馬用大量水潑滅 | |
| B. | 濃堿液濺到皮膚上,用較多水沖洗,然后涂上硼酸溶液 | |
| C. | 實驗結束后將剩余的K和Na不能放回原試劑瓶 | |
| D. | 加熱液體的試管口能正對著自己或別人 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1 | B. | 0.05 | C. | K${\;}_{a1}^{θ}$(H2S) | D. | K${\;}_{{a}_{2}}^{θ}$(H2S) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com