
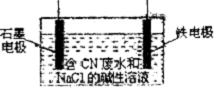
 金屬鋁、鐵、銅及其化合物與生產、科研關系密切.
金屬鋁、鐵、銅及其化合物與生產、科研關系密切.分析 (1)高溫時,鋁與二氧化錳發生置換反應生成錳,為鋁熱反應;
(2)根據發生的電極反應,可以知道金屬鐵是陰極,石墨電極是陽極,根據電解質中離子的放電順序以及電極反應和電子的轉移知識來回答即可;
(3)電解精煉銅時,粗銅作陽極,該電極上Zn、Fe、Ni、Cu失電子,精銅作陰極,該極上是銅離子得電子,陽極上銅以及比銅活潑的金屬會溶解,而沒有銅活潑的金屬會從陽極掉落下,形成陽極泥;
(4)鋁離子、銨離子水解使溶液顯示酸性;根據銨離子水解使溶液顯示酸性,硫酸鋁銨溶液中氫離子濃度大于硫酸鋁溶液的,氫離子抑制了鋁離子的水解.
解答 解:(1)高溫時,鋁與二氧化錳發生置換反應生成錳,反應的方程式為3MnO2+4Al$\frac{\underline{\;高溫\;}}{\;}$3Mn+2Al2O3,
故答案為:3MnO2+4Al$\frac{\underline{\;高溫\;}}{\;}$3Mn+2Al2O3;
(2)①根據發生的電極反應,可以知道金屬鐵是陰極,接電源的負極,故答案為:負極;
②據氧化還原反應的原理,其反應方程式為3Cl2+2CNO-+8OH-═N2+6Cl-+2CO32-+4H2O,故答案為:N2;
③陰極上氫離子放電發生還原反應,生成氫氣,陽極發生氧化反應,陽極的電極反應式為:CN--2e-+2OH-═CNO-+H2O和2Cl--2e-═Cl2↑,
故答案為:氫氣;CN--2e-+2OH-═CNO-+H2O;
(3)a、電解池中,電能不會全部轉化為化學能,還會伴隨熱能等形式的能的產生,故a錯誤;
b、電解精煉銅時,粗銅作陽極,接電源正極,發生氧化反應,故b正確;
c、溶液中Cu2+向陰極移動,在陰極上發生還原反應,故c錯誤;
d、在陽極上,沒有銅活潑的金屬Ag、Pt、Au等金屬會從陽極掉落下,形成陽極泥,利用陽極泥可回收Ag、Pt、Au等金屬,故d正確;
故答案為:ac;
(4)在硫酸鋁銨溶液中,鋁離子、銨離子水解,使溶液顯示酸性,反應的離子方程式為:Al3+﹢3H2O?Al (OH)3﹢3H+; NH4++H2O?NH3•H2O+H+;根據銨離子水解使溶液顯示酸性,硫酸鋁銨溶液中氫離子濃度大于硫酸鋁溶液的,氫離子抑制了鋁離子的水解,況且濃度均為0.1mol•L-1硫酸鋁和硫酸鋁銨兩種水溶液中,鋁離子濃度分別為0.2mol/L和0.1mol/L,所以硫酸鋁銨溶液中鋁離子濃度較大;
故答案為:Al3+、NH4+; 硫酸鋁銨.
點評 本題考查了鋁熱反應、電解原理及其應用、鹽類水解,注意知識的歸納和整理以及應用是關鍵,難度不大.


 七彩題卡口算應用一點通系列答案
七彩題卡口算應用一點通系列答案科目:高中化學 來源: 題型:選擇題
| A. | 通CO的一極是電池的正極 | |
| B. | 該電池工作過程中需不斷補充CO和O2,CO2可循環利用 | |
| C. | 負極反應式為:O2+2CO2+4e-→2CO32- | |
| D. | 正極反應式為:2CO+2CO32-→4CO2+4e- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
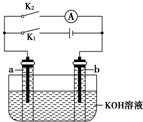 如圖所示,a、b是多孔石墨電極,某同學按圖示裝置進行如下實驗:斷開K2,閉合K1一段時間,觀察到兩支玻璃管內都有氣泡將電極包圍,此時斷開K1,閉合K2,觀察到電流計A的指針有偏轉.下列說法不正確的是( )
如圖所示,a、b是多孔石墨電極,某同學按圖示裝置進行如下實驗:斷開K2,閉合K1一段時間,觀察到兩支玻璃管內都有氣泡將電極包圍,此時斷開K1,閉合K2,觀察到電流計A的指針有偏轉.下列說法不正確的是( )| A. | 斷開K2,閉合K1一段時間,溶液的pH變大 | |
| B. | 斷開K1,閉合K2時,b極上的電極反應式為:2H++2e-═H2↑ | |
| C. | 斷開K2,閉合K1時,a極上的電極反應式為:4OH--4e-═O2↑+2H2O | |
| D. | 斷開K1,閉合K2時,OH-向b極移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HNO3溶液 | B. | NaOH溶液 | C. | H2SO4溶液 | D. | 鹽酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 密閉容器中mA(g)+nB(g)?pC(g),反應達到平衡狀態,經測定增大壓強p時,A的轉化率隨p而變化的曲線如圖所示:
密閉容器中mA(g)+nB(g)?pC(g),反應達到平衡狀態,經測定增大壓強p時,A的轉化率隨p而變化的曲線如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧氣通入氫硫酸 | B. | H2S緩慢通入飽和氯水 | ||
| C. | H2S緩慢通入亞硫酸 | D. | SO2緩慢通入氫硫酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 物質 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKp | 37.4 | 19.3 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com