
| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
分析 (1)反應3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)可以看作題中①×2+②+③得到,根據蓋斯定律可寫出熱化學方程式;
(2)①根據溫度對平衡常數的影響判斷反應的熱效應,根據平衡狀態的特征判斷平衡狀態;
②根據平衡常數等于生成濃度系數次冪之積除以反應濃度系數次冪之積,結合反應中各物質平衡濃度可計算平衡常數;
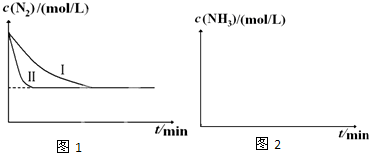
(3)①根據圖象可知,實驗Ⅱ與實驗Ⅰ相比,反應達到平衡的時間變短,平衡不移動,據此判斷;
②合成氨反應為放熱反應,升高溫度平衡逆向移動,平衡時氨氣濃度減小,但反應速率變快,所以達到平衡的時間變短,據此可畫出圖象.
解答 解:(1)根據蓋斯定律,①×2+②+③,整理可得:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-(2Q1+Q2+Q3) kJ/mol,
故答案為:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-(2Q1+Q2+Q3)kJ/mol;
(2)①升高溫度,化學平衡常數減小,說明升高溫度,平衡逆向移動,逆反應方向是吸熱反應,所以該反應的正反應是放熱反應,所以△H<0;
A.由于該反應是反應前后氣體體積不等的反應,若未達到平衡,則體系的壓強就會發生改變,所以體系的壓強不變,則反應達到平衡狀態,正確;
B.密度不變由于反應混合物都是氣體,所以在任何時刻物質的密度都不發生變化,因此不能作為判斷平衡的標志,錯誤;
C.由于該反應是反應前后氣體體積不等的反應,若未達到平衡,則體系的氣體的物質的量就會發生變化,氣體的相對分子質量就會改變,若氣體的相對分子質量不變,則反應達到平衡狀態,正確;
D.c(CO)=c(CH3OH)時反映可能處于平衡狀態,也可能未達到平衡,因此不能作為判斷平衡的標志,錯誤;
故答案為:<; A、C;
②某溫度下,在反應開始是c(CO)=1.0mol/L,c(H2)=3.0mol/L,將 2mol CO和 6mol H2,充分反應 10min后,達到平衡時測得c(CO)=0.2mol/L,則平衡時c(H2)=1.4mol/L,c(CH3OH)=0.8mol/L,則此溫度下的平衡常數K=$\frac{c(C{H}_{3}OH)}{c(CO)•c{\;}^{2}({H}_{2})}$=$\frac{0.8}{0.2×1.{4}^{2}}$=2.04,
故答案為:2.04;
(3)①根據圖象可知:與實驗Ⅰ比較,實驗Ⅱ反應速率大大加快,達到平衡所需要的時間縮短,但是N2平衡濃度沒有改變,因此平衡未發生移動,則改變的條件為加入催化劑,
故答案為:加入催化劑;
②在實驗Ⅲ中改變條件為采用比實驗Ⅰ更高的溫度,由于升高溫度化學反應速率加快,達到平衡所需要的時間縮短,但是由于該反應是放熱反應,升高溫度,平衡向吸熱的逆反應方向移動,因此達到平衡時NH3的含量降低,用圖象表示實驗I和實驗Ⅲ中NH3濃度隨時間變化的示意圖是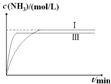 ,
,
故答案為: .
.
點評 本題主要考查熱化學方程式的書寫、反應熱效應的判斷、平衡狀態的判斷、催化劑、溫度對平衡移動的影響的圖象法表示、化學平衡常數的計算的知識,中等難度,答題時注意對平衡常數的理解和平衡移動原理的靈活運用.


科目:高中化學 來源: 題型:選擇題
| A. | 氯水中有下列平衡Cl2+H2O?HCl+HClO,當加入AgNO3溶液后,溶液顏色變淺 | |
| B. | 對2HI(g)?H2(g)+I2(g),平衡體系增大壓強可使顏色變深 | |
| C. | 反應CO+NO2?CO2+NO△H<0,升高溫度可使平衡向逆反應方向移動 | |
| D. | 合成NH3反應,為提高NH3的產率,理論上應采取降低溫度的措施 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 元素編號 | 元素性質或原子結構 |
| X | 最外層電子數是次外層電子數的2倍 |
| Y | 常溫下單質為雙原子分子,其氫化物水溶液呈堿性 |
| Z | 最外層電子數比次外層電子數少5個電子 |
| W | 灼燒其化合物時通過藍色鈷玻璃片觀察火焰為紫色 |
 ,化合物WXY的電子式
,化合物WXY的電子式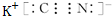 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H+,Cu2+,Fe3+、SO4 2- | B. | Ba2+,Na+,Al3+、Cl- | ||
| C. | K+、Ag+ NH4+,NO3- | D. | Na+、K+、Br-、OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ③⑤ | B. | ③④ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑由小到大的順序:X<Y<Z<W | |
| B. | Z的最高價氧化物能與水反應生成相應的酸 | |
| C. | Y單質在一定條件下可以與氧化鐵發生置換反應 | |
| D. | 室溫下,0.1 mol/L w的氣態氫化物的水溶液的氫離子濃度小于0.1 mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 金屬鋁、鐵、銅及其化合物與生產、科研關系密切.
金屬鋁、鐵、銅及其化合物與生產、科研關系密切.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 現象或操作 | 解 釋 | |
| A | KI淀粉溶液中滴入氯水變藍,再通入SO2,藍色褪去 | SO2具有漂白性 |
| B | 配制SnCl2溶液時,先將SnCl2溶于適量稀鹽酸,再用蒸餾水稀釋,最后在試劑瓶中加入少量的錫粒 | 抑制Sn2+水解,并防止Sn2+被氧化為Sn4+ |
| C | 某溶液中加入硝酸酸化的氯化鋇溶液,有白色沉淀生成 | 不能說明該溶液中一定含有SO42- |
| D | 向濃度均為0.1mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成藍色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com