
分析 (1)濕潤的淀粉碘化鉀試紙變藍色,說明有碘生成,氯氣具有強氧化性,能氧化碘離子生成碘;
(2)氧氣或臭氧也能氧化碘離子;如果為氯氣,氯氣和水反應生成HCl,導致溶液中含有氯離子,氯離子用硝酸酸化的硝酸銀檢驗;
(3)由總反應-①-③得到反應②;在KClO3未完全分解前,冷卻混合物并把它倒入水中,根據溶液顏色判斷是否含有高錳酸鉀;
(4)ClO2具有強氧化性,可以將污水中的S2-氧化成SO42-,自身被還原生成氯離子.
解答 解:(1)濕潤的淀粉碘化鉀試紙變藍色,說明有碘生成,氯氣具有強氧化性,能氧化碘離子生成碘,離子方程式為Cl2+2I-═2Cl-+I2,
故答案為:Cl2+2I-═2Cl-+I2;
(2)碘離子被氧化生成碘,說明氣體具有氧化性;O3或O2也能氧化碘離子,所以試紙變藍的氣體中可能含有氧氣或臭氧;如果為氯氣,氯氣和水反應生成HCl,導致溶液中含有氯離子,氯離子用硝酸酸化的硝酸銀檢驗,如果產生白色沉淀,就說明氣體中含有氯氣,所以可以用硝酸酸化的硝酸銀溶液檢驗,
故答案為:氧化;O3或O2;硝酸酸化的硝酸銀;產生白色沉淀;
(3)由總反應-①-③得到反應②,則反應②方程式為2KMnO4═K2MnO4+MnO2+O2↑,高錳酸鉀溶液呈紫色,要想檢驗固體中含有高錳酸鉀,只要將固體加入水中根據溶液顏色判斷即可,所以操作是:在KClO3未完全分解前,冷卻混合物并把它倒入水中,溶液為血紅色可說明,
故答案為:在KClO3未完全分解前,冷卻混合物并把它倒入水中;2KMnO4═K2MnO4+MnO2+O2↑;
(4)ClO2具有強氧化性,可以將污水中的S2-氧化成SO42-,自身被還原生成氯離子,離子方程式為8ClO2+5S2-+4H2O═5SO42-+8Cl-+8H+或8ClO2+5S2-+8OH-=5SO42-+8Cl-+4H2O,
故答案為:8ClO2+5S2-+4H2O═5SO42-+8Cl-+8H+或8ClO2+5S2-+8OH-=5SO42-+8Cl-+4H2O.
點評 本題考查探究物質的組成,為高頻考點,側重考查物質性質、物質之間的反應及實驗能力,涉及氧化還原反應、離子檢驗、物質成分判斷等知識點,明確物質性質是解本題關鍵,注意常見離子檢驗方法、實驗現象等,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 電解時電解池的陽極一定是陰離子放電 | |
| B. | 反應NH3(g)+HCl(g)═NH4Cl(s)在室溫下可自發進行:則該反應的△H>0 | |
| C. | 其他條件不變,增大壓強,平衡可能移動,但平衡常數一定不變 | |
| D. | 鐵制品表面鑲鋅塊和鐵制品表面鍍錫,都能起到防腐的作用且防腐原理是相同的 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加少量NaCl固體 | B. | 加少量NaOH | C. | 加少量CuSO4固體 | D. | 加少量Na2S固體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 開始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某白色粉末有碳酸鈉和亞硫酸鈉中的一種或兩種組成.某同學為探究其成分,設計實驗方案如圖所示(每種儀器所裝試劑都足量)
某白色粉末有碳酸鈉和亞硫酸鈉中的一種或兩種組成.某同學為探究其成分,設計實驗方案如圖所示(每種儀器所裝試劑都足量)| 錯誤 | 后果 |
| 假設編號 | 相應現象 |
| 假設一 | |
| 假設二 | |
| 假設三 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 )是世界上應用最廣泛的解熱、鎮痛和抗炎藥.乙酰水楊酸受熱易分解,分解溫度為128~135℃.某學習小組在實驗室以水楊酸(鄰羥基苯甲酸)與醋酸酐[(CH3CO)2O]為主要原料合成阿司匹林,制備基本操作流程如下:
)是世界上應用最廣泛的解熱、鎮痛和抗炎藥.乙酰水楊酸受熱易分解,分解溫度為128~135℃.某學習小組在實驗室以水楊酸(鄰羥基苯甲酸)與醋酸酐[(CH3CO)2O]為主要原料合成阿司匹林,制備基本操作流程如下: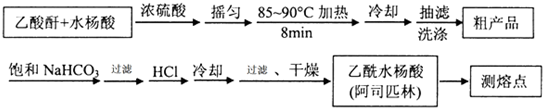
| 名稱 | 相對分子質量 | 熔點或沸點(℃) | 水 |
| 水楊酸 | 138 | 158(熔點) | 微溶 |
| 醋酸 | 102 | 139.4(沸點) | 反應 |
| 乙酸水楊酸 | 180 | 135(熔點) | 微溶 |
 .
.

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HF的電離平衡正向移動,c(H+)增大 | |
| B. | HF的電離程度增大,c(H+)、c(F-)增大、c(HF)減小,則$\frac{c({H}^{+})c({F}^{-})}{c(HF)}$增大 | |
| C. | 稀釋過程中,c(OH-)、$\frac{c({H}^{+})}{c(HF)}$均增大 | |
| D. | 溶液的KW、$\frac{c({F}^{-})}{c({H}^{+})}$、pH均不變 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com