
| 原子序數 | 電子排布式 | 價層電子排布 | 周期 | 族 |
| 17 | ①1s2 2s22p6 3s23p5 | ②3s23p5 | ③3 | ④ⅤⅡA |
| ⑤10 | 1s22s22p6 | ⑥2s22p6 | ⑦2 | ⑧0 |
| ⑨24 | ⑩1s2 2s22p6 3s23p63d5 4s1 | 3d54s1 | (11) | ⅥB |
分析 根據元素原子原子序數等于核外電子數,結合能量最低原理書寫核外電子排布式,周期數等于原子核外電子層數,族等于最外層電子數.
解答 解:原子序數17,說明原子核外電子數為17,根據構造原理、洪特規則特例得到電子排布式為1s2 2s22p6 3s23p5,價電子排布式為3s23p5,最大能層數為3,說明處于第3周期,價電子數為7個,說明處于第ⅤⅡA族;
由電子排布式可知,原子序數=核外電子數=10,價電子排布式為2s22p6,最大能層數為2,價電子數為8,位于第二周期0族;
價電子排布式補齊前面的電子排布為1s2 2s22p6 3s23p63d5 4s1,原子序數=核外電子數=24,最大能層數為4,價電子數為6,位于第四周期ⅥB族;
故答案為:
| 原子序數 | 電子排布式 | 價層電子排布 | 周期 | 族 |
| 1s2 2s22p6 3s23p5 | 3s23p5 | 3 | ⅤⅡA | |
| 10 | 2s22p6 | 2 | 0 | |
| 24 | 1s2 2s22p6 3s23p63d5 4s1 | 4 |
點評 本題考查了原子核外電子排布和周期表位置的關系,難度一般,根據元素的原子序數便可以寫出原子的電子排布式,但是要注意洪特規則,既有些元素例如銅,鉻等其價電子會重排,使得各個電子層達到全充滿或者半充滿狀態,這樣能量比較低,構型穩定.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
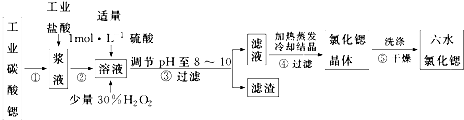
| SrSO4 | BaSO4 | Sr(OH)2 | Fe(OH)3 | Fe(OH)2 | |
| Ksp | 3.3×10-7 | 1.1×10-10 | 3.2×10-4 | 2.6×10-39 | 4.87×10-17 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
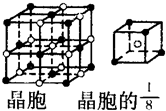 A、B、C、D、E都是元素周期表中前20號元素,原子序數依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高氧化物的水化物兩兩混合均能發生反應生成鹽和水.
A、B、C、D、E都是元素周期表中前20號元素,原子序數依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高氧化物的水化物兩兩混合均能發生反應生成鹽和水. ”表示)位于該正方體的頂點或面心;陰離子(用“
”表示)位于該正方體的頂點或面心;陰離子(用“ ”表示)均位于小正方體中心.該化合物的電子式是
”表示)均位于小正方體中心.該化合物的電子式是 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2s22p2和2s22p4 | B. | 3s23p4和2s22p4 | C. | 3s2和2s22p5 | D. | 3s1和3s23p4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ②③⑤ | C. | ①③⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:W>Z>Y>X | |
| B. | Y元素在周期表中的位置為第3周期第ⅣA族 | |
| C. | 1 mol甲與足量的乙完全反應共轉移1 mol電子 | |
| D. | 化合物甲中只有離子鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
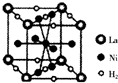 鎳及其化合物在合金材料以及催化劑等方面應用廣泛.
鎳及其化合物在合金材料以及催化劑等方面應用廣泛. ④HCHO,其中碳原子采取sp2雜化有①③④,HCHO分子內σ鍵與π鍵個數之比為3:1.
④HCHO,其中碳原子采取sp2雜化有①③④,HCHO分子內σ鍵與π鍵個數之比為3:1.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | N4的摩爾質量是56 g | |
| B. | N4與N2互為同位素 | |
| C. | 相同質量的N4和N2含原子個數比為1:2 | |
| D. | N4與N2互為同素異形體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com