
| A. | 自來水 | B. | 0.5 mol•L-1鹽酸 | ||
| C. | 0.5 mol•L-1 醋酸 | D. | 0.5 mol•L-1 氨水 |
分析 溶液混合后導電能力變化的大小,關鍵是看混合后溶液中自由移動的離子濃度的變化.B項中物質均是強電解質,加入NaOH后生成物仍是強電解質,故導電性變化不大;A、C、D項中物質由于難電離,離子濃度很小,當加入NaOH后,離子濃度增大很多,成為強電解質,故導電能力與原來相比變化很大.
解答 解:導電能力的大小,要比較單位體積內離子濃度的多少.
A、因水是極弱的電解質,導電性極弱,加入氫氧化鈉后,氫氧化鈉是強電解質,溶液中主要的是鈉離子和氫氧根,導電性增強,故A錯誤;
B、未加氫氧化鈉固體,導電的有氯離子和氫離子,加入氫氧化鈉后主要是鈉離子,氯離子,而參加反應的氫離子正好與鈉離子的量相當.所以導電性變化不大,故B正確;
C、原來是弱電解質,離子較少,加入強堿以后,變為強電解質,導電能力增強,故C錯誤;
D、一水合氨是弱電解質,加入NaOH后,溶液中離子的濃度變大,故導電能力增強,故D錯誤;
故選B.
點評 本題考查溶液中離子濃度大小比較,以此判斷溶液的導電性,溶液混合后導電能力變化的大小,關鍵是看混合后溶液中自由移動的離子濃度的變化,題目難度不大.


 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 最高價氧化物的化學式為As2O5 | |
| B. | 氣態氫化物的穩定性強于磷化氫而弱于硫化氫 | |
| C. | 砷單質在通常狀況下為固態 | |
| D. | 砷酸是一種弱酸,酸性比磷酸酸性弱 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
 如圖,利用培養皿探究氨氣的性質.實驗時向NaOH固體上滴幾滴濃氨水,立即用另一表面皿扣在上面.下列對實驗現象所做的解釋正確的是( )
如圖,利用培養皿探究氨氣的性質.實驗時向NaOH固體上滴幾滴濃氨水,立即用另一表面皿扣在上面.下列對實驗現象所做的解釋正確的是( )| A. | 濃鹽酸附近產生白煙:NH3與HCl氣體反應產生了NH4Cl固體 | |
| B. | 濃硫酸附近無明顯現象:NH3與濃硫酸不發生反應 | |
| C. | 氯化物溶液變渾濁:該溶液一定是AlCl3溶液 | |
| D. | 濕潤的紅色石蕊試紙變藍:NH3的水溶液顯堿性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
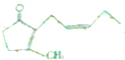 ),其香味濃郁,被廣泛應用于化妝品的制造中.
),其香味濃郁,被廣泛應用于化妝品的制造中.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ①⑤ | C. | ②⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2.43kJ | B. | 4.86kJ | C. | 43.8kJ | D. | 87.5kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com