
【題目】某興趣小組用題圖1裝置(夾持裝置略)收集某葡萄酒中SO2 , 并對含量進行測定. 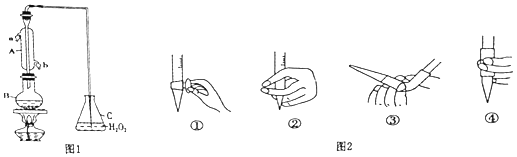
(1)儀器A的名稱是 .
(2)B中加入300.00mL葡萄酒和適量鹽酸,加熱使SO2全部逸出并與C中H2O2完全反應,其化學方程式為 .
(3)除去C中過量的H2O2 , 然后用0.0900mol/LNaOH標準溶液進行滴定,滴定前排氣泡時,應選擇圖2中的 .
(4)若滴定終點時溶液的pH=8.8,則選擇的指示劑為 .
(5)該測定結果往往比實際值偏高,分析是由于采用試劑不當引起的,可能的原因為 .
【答案】
(1)冷凝管或冷凝器
(2)SO2+H2O2=H2SO4
(3)③
(4)酚酞
(5)鹽酸易揮發
【解析】解:(1)根據儀器A的構造可知,儀器A為冷凝管,冷凝管中通水方向采用逆向通水法,冷凝效果最佳,所以應該進水口為b,
所以答案是:冷凝管或冷凝器;(2)雙氧水具有氧化性,能夠將二氧化硫氧化成硫酸,反應的化學方程式為:SO2+H2O2=H2SO4,
所以答案是:SO2+H2O2=H2SO4;(3)氫氧化鈉溶液為堿性溶液,應該使用堿式滴定管,堿式滴定管中排氣泡的方法:把滴定管的膠頭部分稍微向上彎曲,再排氣泡,所以排除堿式滴定管中的空氣用③的方法,
所以答案是:③;(4)滴定終點時溶液的pH=8.8,應該選擇酚酞做指示劑(酚酞的變色范圍是8.2~10.0);
所以答案是:酚酞;(5)由于鹽酸是揮發性酸,揮發的酸消耗氫氧化鈉,使得消耗的氫氧化鈉溶液體積增大,測定結果偏高;因此改進的措施為:用不揮發的強酸,如硫酸代替鹽酸,或用蒸餾水代替葡萄酒進行對比實驗,扣除鹽酸揮發的影響,
所以答案是:鹽酸易揮發.


科目:高中化學 來源: 題型:
【題目】鉛蓄電池是典型的可充型電池,它的正負極是情性材料,放電時的電池總反應式為:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O。請回答下列問題,放電時正極的電極反應式是________________________;正極區pH值將____(填“變大”、“變小”或“不變”);電解液中H2SO4的濃度將_____(填“變大”、“變小”或“不變”);當外電路通過1mol電子時,理論上負極板的質量___(填“增加”或“減小”)________g。
2PbSO4+2H2O。請回答下列問題,放電時正極的電極反應式是________________________;正極區pH值將____(填“變大”、“變小”或“不變”);電解液中H2SO4的濃度將_____(填“變大”、“變小”或“不變”);當外電路通過1mol電子時,理論上負極板的質量___(填“增加”或“減小”)________g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鋁在酸性或堿性溶液中均可與NO3-發生氧化還原反應,轉化關系如下:
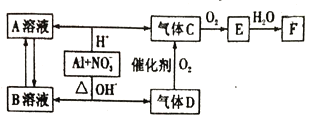
請回答下列問題:
(1) 氣體D 與F 反應可生成鹽,該鹽的化學式為_________。
(2) C、E排入大氣中會造成大氣污染,在催化劑存在下,D可以將C、E轉化為無毒的氣態單質,該單質的結構式是___________。
(3) 氣體D轉化為氣體C 的化學方程式__________。
(4) Al 與NO3-在酸性條件下反應,Al與被還原的NO3-的物質的量之比是_____________。
(5) Al 與NO3-在堿性條件下反應的離子方程式為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種以2 molL-1的Na2SO4溶液為電解質溶液的鈉離子電池的總反應如下(P為+5價):NaTi2(PO4)3+Zn+Na2SO4![]() Na3Ti2(PO4)3+ZnSO4下列有關說法正確的是( )
Na3Ti2(PO4)3+ZnSO4下列有關說法正確的是( )
A. 放電時,NaTi2(PO4)3發生氧化反應
B. 放電時,Na+向鋅棒一極移動
C. 充電時,陽極反應式為[Ti2(PO4)3]+-2e-=[Ti2(PO4)3]3+
D. 充電時,每轉移0. 2 mol電子,陰極增重6.5 g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示三個燒瓶中分別裝人含酚酞的0.01mol/LCH3COONa溶液,并分別放置在盛有水的燒杯中,然后向燒杯①中加入生石灰,向燒杯③中加入NH4NO3晶體,燒杯②中不加任何物質.則下列敘述正確的是( ) 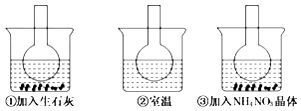
A.①說明水解反應為放熱反應
B.③說明水解反應為吸熱反應
C.①中溶液紅色變淺
D.③中溶液紅色變深
查看答案和解析>>
科目:高中化學 來源: 題型:
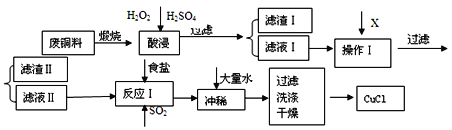
【題目】CuCl是有機合成的重要催化劑,并用于顏料、防腐等工業。工業上由廢銅料(含Fe、Al及其化合物、SiO2雜質),生產CuCl的工藝流程如下:
物質 | 開始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Cu(OH)2 | 5.6 | 6.7 |
Al(OH)3 | 3.8 | 4.7 |
已知:CuCl溶于NaCl的濃溶液可生成CuCl2-,CuCl2-的溶液用水稀釋后可生成CuCl沉淀。
(1)煅燒的主要目的是:______________________________________。
(2)操作Ⅰ為調節溶液的pH值,范圍為___________,加入的物質X可以是_________________________ 。
A.CuO B.Cu(OH)2 C .NaOH 溶液 D.CaCO3
(3)濾渣I的主要成分是________,濾渣Ⅱ的主要成分是_________。
(4)往濾液Ⅱ中加入食鹽并通入SO2可生成CuCl-,寫出反應的離子方程式________________________________________________________________________________________ 。
(5)在反應Ⅰ中,加熱并使用濃NaC1溶液,主要目的是_____________________________________________________________________________________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上用菱錳礦(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等雜質]為原料制取二氧化錳,其流程示意圖如下:
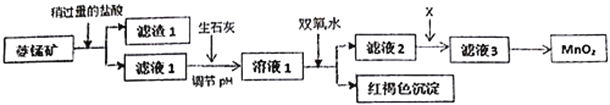
已知:生成氫氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
開始沉淀時 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀時 | 9.8 | 8.3 | 3.7 | 6.7 |
Ksp(CuS)=6.3×10-16 Ksp(MnS)= 3×10-14
注:金屬離子的起始濃度為0.1 mol/L
回答下列問題:
(1)含雜質的菱錳礦使用前需將其粉碎,主要目的是_________________________。濾渣1的成分是_________,鹽酸溶解MnCO3的離子方程式是_________________________________;
(2)用生石灰而不用NaOH調節pH的原因是_______________________________;
(3)濾液2中加入某種物質X可以除去Cu2+,最適合的是_______________;
A.MnO2 B.NaOH C.MnS
該反應的離子方程式是____________________________;
(4)將MnCl2轉化為MnO2的一種方法是將酸化的NaClO3溶液氧化Mn2+,請補充并配平下列方程;____Mn2++_____ClO3-+______=____Cl2↑+____MnO2+_________;_________________
(5)將MnCl2轉化為MnO2的另一種方法是電解法。(填“正極”或“負極”或“陰極”或“陽極”)
① MnO2在電解池的__________________(填“正極”或“負極”或“陰極”或“陽極”)生成;
② 若直接電解MnCl2溶液,生成MnO2的同時會產生少量Cl2。檢驗Cl2的操作是_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知100℃時,水的離子積常數Kw=1×10-12,對于該溫度下pH=l1的氨水,下列敘述正確的是
A. 向該溶液中加入同溫同體積pH=1的鹽酸,反應后溶液呈中性
B. 溫度降低至25℃,該氨水溶液中H2O電離出的H+濃度小于10-11mol/L
C. 該氨水溶液中加入NH4Cl溶液,NH3·H2O的電離能力增強
D. 滴加等濃度等體積的硫酸,得到的溶液中存在電離平衡:NH4HSO4(aq)![]() NH4+(aq)+H+(aq)+SO42-(aq)
NH4+(aq)+H+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作正確且能達到相應實驗目的的是
選項 | 實驗目的 | 實驗操作 |
A | 配制FeCl3溶液 | 將FeCl3固體溶解于適量蒸餾水 |
B | 稱取2.0gNaOH 固體 | 先在托盤上各放一張濾紙,然后在右盤上添加2g 砝碼,左盤上添加NaOH 固體 |
C | 檢驗溶液中是否含有NH4+ | 取少最試液于試管中,加入NaOH溶液并加熱,用濕潤的紅色石蕊試紙檢驗產生的氣體 |
D | 驗證鐵的吸氧腐蝕 | 將鐵釘放入試管中,用鹽酸浸沒 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com