

分析 (1)根據流程圖可知,煅燒過程中,鉻鐵礦中的Al2O3與純堿反應生成了CO2,然后依據元素守恒配平,得化學方程式.
(2)①酸化時發生的反應為:2CrO42-+2H+?Cr2O72-+H2O,據此寫出K的表達式;
②根據守恒列關系式:2Cr~2CrO42-~Cr2O72-,列式計算得n(Cr2O72-)和n(CrO42-)剩余,進而求出酸化后所得溶液中c(Cr2O72-);
③根據反應 2CrO42-+2H+═?Cr2O72-+H2O及平衡常數K═1014,可求出c(H+)=1.0×10-6mol,則PH=6,
(3)①根據沉淀溶解平衡CrO42-+Ba2+?BaCrO4及Ksp(BaCrO4)=C(CrO42-)×C(Ba2+)=1.2×10-10,可得C(Ba2+);
②酸性條件下CrO42-與亞鐵離子反應生成Cr3+和Fe3+、水.
解答 解:(1)根據流程圖可知,煅燒過程中,鉻鐵礦中的Al2O3與純堿反應生成了CO2,然后依據元素守恒配平,得化學方程式為Al2O3+Na2CO3$\frac{\underline{\;煅燒\;}}{\;}$2NaAlO2+CO2↑,
故答案為:Al2O3+Na2CO3$\frac{\underline{\;煅燒\;}}{\;}$2NaAlO2+CO2↑.
(2)①酸化時發生的反應為:2CrO42-+2H+?Cr2O72-+H2O,其K的表達式為K=$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}(Cr{{O}_{4}}^{2-}){c}^{2}({H}^{+})}$,
故答案為:$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}(Cr{{O}_{4}}^{2-}){c}^{2}({H}^{+})}$;
②若1L酸化后所得溶液中含鉻元素的質量為28.6g,CrO42-有$\frac{10}{11}$轉化為Cr2O72-,說明鉻元素有$\frac{10}{11}$轉化為Cr2O72-
根據守恒列關系式:2Cr~2CrO42-~Cr2O72-
2 1
$\frac{28.6×\frac{10}{11}}{52}$ mol n(Cr2O72-)
則n(Cr2O72-)=0.25mol,n(CrO42-)剩余=0.05mol;
則①酸化后所得溶液中c(Cr2O72-)=$\frac{n}{V}$=0.25mol•L-1;
故答案為:0.25mol•L-1;
③設H+的物質的量濃度為amol/L,
2CrO42-+2H+?Cr2O72-+H2O
平衡(mol/L) 0.05 a 0.25
平衡常數K=$\frac{0.25}{0.0{5}^{2}×{a}^{2}}$═1014,
則a=1.0×10-6mol,PH=6,
故答案為:6;
(3)①CrO42-+Ba2+?BaCrO4
5.0×10-7mol•L-1 C(Ba2+)
Ksp(BaCrO4)=C(CrO42-)×C(Ba2+)=5.0×10-7×C(Ba2+)=1.2×10-10,
C(Ba2+)=2.4×10-4mol/L
故答案為:2.4×10-4;
②酸性條件下CrO42-與亞鐵離子反應生成Cr3+和Fe3+、水,其反應的離子方程式為:CrO42-+3Fe2++8H+=Cr3++3Fe3++4H2O;
故答案為:CrO42-+3Fe2++8H+=Cr3++3Fe3++4H2O.
點評 本題考查了物質的分離提純流程,主要考查了操作流程分析、離子檢驗、金屬的冶煉、溶度積常數的計算、方程式的書寫等,題目難度中等,側重于考查學生分析問題、解決問題能力和計算能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 放電時,Fe是負極,NiO2是正極 | |
| B. | 蓄電池的電極可以浸入某種堿性電解質溶液中 | |
| C. | 充電時,陰極上的電極反應為:Fe(OH)2+2e-=Fe+2OH- | |
| D. | 放電時,電解質溶液中的陰離子向正極方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
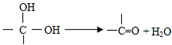 ,如圖中X分子式為C4H2Br2O4,為六元環化合物,核磁共振氫譜表明其分子中只有一種類型H原子的吸收峰.
,如圖中X分子式為C4H2Br2O4,為六元環化合物,核磁共振氫譜表明其分子中只有一種類型H原子的吸收峰.
 .它可以發生ab反應(填字母)a、取代 b、消去c、加成
.它可以發生ab反應(填字母)a、取代 b、消去c、加成 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水的電離是一個放熱過程 | |
| B. | 35℃時,c(H+)>c(OH-) | |
| C. | 25℃時,pH=3的鹽酸中由水電離產生的c(OH-)=1.0×10-3mol/L | |
| D. | 25℃時,向溶液中加入稀氨水,平衡逆向移動,Kw不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 稀硝酸與氫氧化鋇溶液反應:H++OH-═H2O | |
| B. | 鐵與稀鹽酸反應:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 碳酸鈉與稀硝酸反應:Na2CO3+2H+═2Na++CO2↑+H2O | |
| D. | 氯化鋁溶液與過量氨水反應:Al3++OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com