
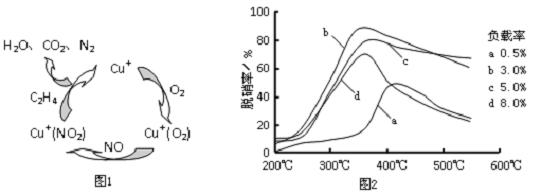
分析 (1)硫的氧化物、氮的氧化物是形成酸雨的主要成因,煙氣脫硫、脫硝可以防止酸雨的發生;
(2)①反應中氨氣中的N元素由-3價升高為0價,據此計算轉移3mol電子參加反應的氨氣的物質的量,再根據方程式計算生成的氮氣,根據V=nVm計算氮氣的體積;
②a、2H2(g)+O2(g)═2H2O (g)△H=-483.6kJ•mol-1
b、N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
c、N2(g)+O2(g)═2NO(g)△H=-180.5kJ•mol-1
依據蓋斯定律計算,a×3-b×2-c×3得到反應的熱化學方程式;
(3)①圖1可知,在催化劑的作用下,C2H4與NO、O2反應最終生成N2、CO2、H2O,據此寫出反應的總方程式;
②為達到最佳脫硝效果,應滿足脫硝率高,負載率低,適宜的溫度.
解答 解:(1)煙氣脫硫、脫硝可以降低硫的氧化物、氮的氧化物含量,防止酸雨的發生,
故答案為:防止酸雨的發生;
(2)①反應中氨氣中的N元素由-3價升高為0價,化合價升高3價,澤爾轉移3mol電子參加反應的氨氣的物質的量為:$\frac{3mol}{3}$=1mol,根據方程式可知生成的氮氣的物質的量為:1mol×$\frac{3+2x}{4x}$=$\frac{3+2x}{4x}$mol,
氮氣的體積為:$\frac{3+2x}{4x}$mol×22.4L/mol=$\frac{16.8+11.2x}{x}$L,
故答案為:$\frac{16.8+11.2x}{x}$;
②a、2H2(g)+O2(g)═2H2O (g)△H=-483.6kJ•mol-1
b、N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
c、N2(g)+O2(g)═2NO(g)△H=-180.5kJ•mol-1
依據蓋斯定律計算,a×3-b×2-c×3得到反應的熱化學方程式為:6NO(g)+4NH3(g)═5N2(g)+6H2O(g)的△H=-724.5kJ•mol-1
故答案為:-724.5kJ•mol-1;
(3)①根據圖1可知,在催化劑的作用下,C2H4與NO、O2反應最終生成N2、CO2、H2O,反應總方程式為:6NO+3O2+2C2H4$\frac{\underline{\;催化劑\;}}{\;}$3N2+4CO2+4H2O,
故答案為:6NO+3O2+2C2H4$\frac{\underline{\;催化劑\;}}{\;}$3N2+4CO2+4H2O;
②由圖可知,b曲線的最高點處,脫硝率高,負載率低,溫度溫度適宜,適宜適合條件為350℃、負載率3%,
故答案為:350℃、負載率3%.
點評 本題以煙氣的脫硫和脫硝為載體,考查環境保護、氧化還原反應計算、方程式書寫等知識,題目難度中等,本題注意把握數據處理和圖象分析.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 化學鍵 | H-H | H-F | H-Br | H-I |
| 鍵能(kJ/mol) | 436 | 565 | 368 | 297 |
| A. | 氫氣 | B. | 氟化氫 | C. | 溴化氫 | D. | 碘化氫 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 開始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol任何氣體的體積約是22.4L | |
| B. | 標準狀況下,1mol H2O 所占的體積約為22.4L | |
| C. | 常溫常壓下,1mol O2 所占的體積約為22.4L | |
| D. | 標準狀況下,體積為22.4LN2 和N2O 的混合氣體,其中約含有2mol N 原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 純鹽酸、空氣、硫酸、干冰 | B. | 蒸餾水、氨水、碳酸氫鈉、二氧化硫 | ||
| C. | 膽礬、鹽酸、鐵、碳酸鈣 | D. | 生石灰、濃硫酸、氯化銅、碳酸鈉 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 化合物中各元 素原子個數比 | A:C=1:1 | A:B=1:1 | D:C=1:1 | E:F=1:3 | B:F=1:4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com