
(12分)甲醇可作為燃料電池的原料。以CH4和H2O為原料,通過下列反應來制備甲醇。
I: CH4(g)+H2O(g)=CO(g) + 3H2(g) △H =+206.0 kJ·mol-1
II:CO(g)+2H2(g)=CH3OH (g) △H =-129.0 kJ·mol-1
(1)CH4(g)與H2O(g)反應生成CH3OH (g)和H2(g)的熱化學方程式為 。
(2)將1.0 mol CH4和2.0 mol H2O ( g )通入容積為10 L的反應室,在一定條件下發生反應I,測得在一定的壓強下CH4的轉化率與溫度的關系如下圖。
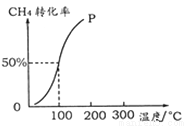
①假設100 ℃時達到平衡所需的時間為5 min,則用H2表示該反應的平均反應速率為 。
②100℃時反應I的平衡常數為 。
(3)在壓強為0.1 MPa、溫度為300℃條件下,將a mol CO與3a mol H2的混合氣體在催化劑作用下發生反應II生成甲醇,平衡后將容器的容積壓縮到原來的l/2,其他條件不變,對平衡體系產生的影響是 (填字母序號)。
A.c ( H2 )減少 B.正反應速率加快,逆反應速率減慢
C.CH3OH 的物質的量增加 D.重新平衡c ( H2 )/ c (CH3OH )減小
E.平衡常數K增大
(4)甲醇對水質會造成一定的污染,有一種電化學法可消除這種污染,其原理是:通電后,將Co2+氧化成Co3+,然后以Co3+ 做氧化劑把水中的甲醇氧化成CO2而凈化。實驗室用下圖裝置模擬上述過程:
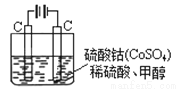
① 寫出陽極電極反應式 。
② 寫出除去甲醇的離子方程式 。
(12分)(1)CH4(g) +H2O(g)= CH3OH (g) + H2(g) △H=+77.0kJ/mol(2分)
(2)0.03mol·L-1·min-1(2分)2.25×10-2(2分)
(3)C、D(共2分)
(4)Co2+-e-= Co3+(2分)6 Co3++H2O+ CH3OH= CO2↑+6 Co2+ +6H+(2分)
【解析】
試題分析:(1)根據蓋斯定律可得,所求方程式=I+II,所以CH4(g)與H2O(g)反應生成CH3OH (g)和H2(g)的熱效應△H=+206.0 kJ·mol-1-129.0 kJ·mol-1=+77.0kJ/mol,所以熱化學方程式為CH4(g) +H2O(g)= CH3OH (g) + H2(g) △H=+77.0kJ/mol;
(2)100℃時,甲烷的轉化率是50%,則生成氫氣的物質的量是1.5mol,所以用H2表示該反應的平均反應速率為1.5mol/10L/5min=0.03 mol·L-1·min-1;此時甲烷、CO的濃度是0.05 mol·L-1,水蒸氣的濃度0.15 mol·L-1,氫氣的濃度是0.15 mol·L-1,所以平衡常數K=0.153 ?0.05/0.15 ?0.05=0.0225;
(3)恒溫恒壓條件下,容器體積縮小為原來的l/2,壓強增大,則平衡正向移動。再達平衡時,氫氣的濃度大于原來的濃度而小于原來的2倍,所以氫氣的濃度增大,A錯誤;壓強增大,正逆反應速率都增大,B錯誤;平衡正向移動,甲醇的物質的量增大,C正確;容器體積縮小,氫氣、甲醇的濃度都變為原來的2倍,由于平衡正向移動,所以氫氣的濃度小于2倍,而甲醇的濃度大于原來的2倍,因此重新平衡c ( H2 )/ c (CH3OH )減小,D正確;溫度不變,平衡常數不變,E錯誤,答案選CD;
(4)該裝置是電解池裝置,陽極發生氧化反應,根據題意:通電后,將Co2+氧化成Co3+,所以陽極是Co2+發生氧化反應,電極反應式為Co2+-e-= Co3+;以Co3+ 做氧化劑把水中的甲醇氧化成CO2而凈化,Co3+被還原為Co2+,所以除去甲醇的離子方程式是6 Co3++H2O+ CH3OH= CO2↑+6 Co2+ +6H+。
考點:考查蓋斯定律的應用,化學平衡的移動、反應速率的計算,電化學反應原理的應用


 期末沖刺100分創新金卷完全試卷系列答案
期末沖刺100分創新金卷完全試卷系列答案科目:高中化學 來源:2015屆湖北省高三上學期起點考試化學試卷(解析版) 題型:選擇題
鎳鎘(Ni—Cd)可充電電池在現代生活中有廣泛應用。已知某鎳鎘電池的電解質溶液為 KOH溶液,其充、放電按下式進行:Cd + 2NiOOH + 2H2O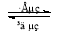 Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2
有關該電池的說法正確的是( )
A.充電過程是化學能轉化為電能的過程
B.放電時電解質溶液中的OH-向正極移動
C.充電時陽極反應:Ni(OH)2 -e— + OH- == NiOOH + H2O
D.放電時負極附近溶液的堿性不變
查看答案和解析>>
科目:高中化學 來源:2015屆浙江省協作體高考摸底測試理科綜合化學試卷(解析版) 題型:選擇題
已知:常溫下濃度為0.1 mol·L-1的下列溶液的pH如表:
溶質 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
下列有關說法正確的是( )。
A.在相同溫度下,同濃度的三種酸溶液的導電能力順序:H2CO3<HClO<HF
B.若將CO2 通入0.1 mol·L-1Na2CO3溶液中至溶液中性,則溶液中
2 c (CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1
C.根據上表, 水解方程式ClOˉ+ H2O HClO + OHˉ的平衡常數K≈10ˉ7.6
HClO + OHˉ的平衡常數K≈10ˉ7.6
D.向上述NaClO 溶液中通HF氣體至恰好完全反應時:
c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
查看答案和解析>>
科目:高中化學 來源:2015屆浙江省溫州市十校聯合體高二下學期期中聯考化學試卷(解析版) 題型:選擇題
2008年北京奧運會的國家游泳中心(水立方)的建筑采用了膜材料ETFE,該材料為四氟乙烯與乙烯的共聚物,四氟乙烯也可與六氟丙烯共聚成聚全氟乙丙烯。下列說法錯誤的是 ( )
A.合成ETFE及合成聚全氟乙丙烯的反應均為加聚反應
B.ETFE分子中可能存在“—CH2—CH2—CF2—CF2—”的連接方式
C.聚全氟乙丙烯分子的結構簡式可能為
D.四氟乙烯分子中含有共價鍵
查看答案和解析>>
科目:高中化學 來源:2015屆浙江省溫州市十校聯合體高二下學期期中聯考化學試卷(解析版) 題型:選擇題
有關化學用語正確的是 ( )
A.溴乙烷的分子式C2H5Br
B.乙醇的結構簡式C2H6O
C.四氯化碳的電子式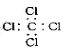
D.乙烯的結構簡式CH2CH2
查看答案和解析>>
科目:高中化學 來源:2015屆浙江省溫州市十校聯合體高三上學期期初聯考化學試卷(解析版) 題型:選擇題
臭氧是理想的煙氣脫硝劑,其脫硝反應為: 2NO2(g)+O3(g)  N2O5(g)+O2(g),反應在恒容密閉容器中進行,下列由該反應相關圖像作出的判斷正確的是( )
N2O5(g)+O2(g),反應在恒容密閉容器中進行,下列由該反應相關圖像作出的判斷正確的是( )
A | B | C | D |
|
|
|
|
升高溫度,平衡常數減小 | 0~3s內,反應速率為: v(NO2)=0.2mol?L-1 | t1時僅加入催化劑,平衡正向移動 | 到達平衡時,僅改變x,則x為c(O2) |
查看答案和解析>>
科目:高中化學 來源:2015屆浙江省溫州市十校聯合體高三上學期期初聯考化學試卷(解析版) 題型:選擇題
下列敘述I和II均正確并有因果關系的是( )
選項 | 敘述I | 敘述II |
A | KNO3的溶解度大 | 用重結晶法除去KNO3中混有的NaCl |
B | BaSO4難溶于酸 | 用鹽酸和BaCl2溶液檢驗SO42- |
C | NH3能使酚酞溶液變紅 | NH3可用于設計噴泉實驗 |
D | Ca(OH)2能制成澄清石灰水 | 可配制2.0 mol?L-1的Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化學 來源:2015屆浙江省杭州地區六校高二下學期期中聯考化學試卷(解析版) 題型:填空題
A、B、C、D、E是常見化合物或單質,有如下轉化關系(略去條件和副產品)。
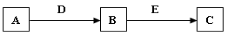
(1)若D為氧氣,C為NaAlO2,試寫出B轉化為C的化學方程式 。
(2)若A為氣態單質,B為漂白粉的有效成份,C具有漂白性。試寫A轉化為B的化學方程式 。畫出組成單質A的元素原子結構示意圖 。
(3)若A、B、C均為鈉鹽的水溶液,D、E均為鹵素單質,請寫出B轉化為C的離子方程式 。
(4)若A常溫下為固態單質,化合物B在常溫常壓下為氣體,B和C的相對分子質量之比為4:5,且D、E為同一物質,則B為 。
(5)若B、D為質子數小于18的元素原子形成的單質,A、E、C均為氧化物,且D所含元素原子的質子數是B的2倍,A轉化為B,B轉化為C兩個反應均屬置換反應,請寫出A轉化為B的化學方程式 。
查看答案和解析>>
科目:高中化學 來源:2015屆浙江省高二下學期期中化學試卷(解析版) 題型:選擇題
下列說法正確的是
A.1 mol阿司匹林( )與足量的NaOH溶液反應,消耗NaOH最大的物質的量為2mol
)與足量的NaOH溶液反應,消耗NaOH最大的物質的量為2mol
B.汽油、柴油等礦物油與植物油主要成分都是烴,均可以萃取溴水中的溴
C.丙氨酸和苯丙氨酸脫水,最多可生成4種二肽
D.按系統命名法,化合物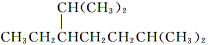 的名稱為2?甲基?5?異丙基庚烷
的名稱為2?甲基?5?異丙基庚烷
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com