
鎳鎘(Ni—Cd)可充電電池在現代生活中有廣泛應用。已知某鎳鎘電池的電解質溶液為 KOH溶液,其充、放電按下式進行:Cd + 2NiOOH + 2H2O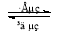 Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2
有關該電池的說法正確的是( )
A.充電過程是化學能轉化為電能的過程
B.放電時電解質溶液中的OH-向正極移動
C.充電時陽極反應:Ni(OH)2 -e— + OH- == NiOOH + H2O
D.放電時負極附近溶液的堿性不變
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源:2015屆湖北省高三上學期起點考試化學試卷(解析版) 題型:填空題
(8分)氫氧化鉀是重要的工業產品。請回答:
(1)鋁與氫氧化鉀溶液反應的離子方程式是 。
(2)工業品氫氧化鉀的溶液中含有某些含氧酸根雜質,可用離子交換膜法電解提純。電解槽內裝有陽離子交換膜(只允許陽離子通過),其工作原理如圖所示。
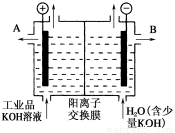
①該電解槽的陽極反應式是 。
②通電開始后,陰極附近溶液pH會增大,請簡述原因: 。
③除去雜質后的氫氧化鉀溶液從液體出口 (填寫“A”或“B”)導出。
查看答案和解析>>
科目:高中化學 來源:2015屆湖北省新高三起點調研測試化學試卷(解析版) 題型:填空題
(15分) 【化學 ― 選修 3 物質結構與性質】
氮的化合物在無機化工領域有著重要的地位。請回答下列問題:
(1)基態氮原子的價電子排布圖為 。
(2)氮的最高價氧化物為無色晶體,它由兩種離子構成:已知其陰離子構型為平面正三角形,則其陽離子的構型為 形,陽離子中氮的雜化方式為 。
(3)某氮鋁化合物X具有耐高溫、抗沖擊、導熱性好等優良性質,廣泛用于陶瓷工業等領域。工業上用氮氣、氧化鋁和碳在一定條件下反應生成CO和X (X的晶體結構如圖所示),工業制備 X 的化學方程式為 。
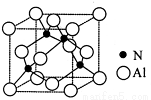
(4)X晶體中包含的化學鍵類型為 (填字母標號)。
A .離子鍵 B .共價鍵 C .配位鍵 D .金屬鍵
(5)已知氮化硼與X晶體類型相同,且氮化硼的熔點比X高,其原因 是 。
(6)若X的密度為ρg/cm3,則晶體中最近的兩個Al 原子的距離為 cm (阿伏加德羅常數用 NA表示,不必化簡)。
查看答案和解析>>
科目:高中化學 來源:2015屆湖北省新高三起點調研測試化學試卷(解析版) 題型:選擇題
NA表示阿伏加德羅常數的值,下列敘述正確的是
A .84gNaHCO3晶體中含有 NA個 CO2- 3
B.0 . lmol/LK2CO3溶液中,陰離子總數大于 0.1NA
C. 1.8g石墨和C60的混合物中,碳原子數目為 0.15NA
D.標準狀況下,22.4 L CCl4中含有的共用電子對數目為 4NA
查看答案和解析>>
科目:高中化學 來源:2015屆湖北省高三上學期起點考試化學試卷(解析版) 題型:填空題
碳及其化合物有廣泛應用。
(1)工業冶煉鋁,以石墨為陽極。陽極反應式為 ,可能發生副反應有 。
(2)一氧化碳和空氣在酸性介質中構成燃料電池,負極反應式為 。
(3)向75 mL 4 mol?L-1KOH溶液中緩慢通入4480 mL CO2氣體(標準狀況)恰好完全被吸收。①寫出該反應的離子方程式: 。(只用一個離子方程式表示)
②該吸收溶液中離子濃度大小排序為 。
(4)已知:① 2H2(g)+O2(g)=2H2O(l) △H1=—571.6kJ?mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2 = —566.0kJ?mol-1
③ CO(g)+2H2(g) CH3OH(g) △H3 = —90.8kJ?mol-1
CH3OH(g) △H3 = —90.8kJ?mol-1
計算甲醇蒸氣的燃燒熱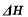 = 。
= 。
(5)某溫度下,發生可逆反應:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g) 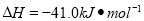
①向某容器中充入1.0 molH2和1.0 molCO2(g),在一定條件下發生上述反應。混合氣體中CO的物質的量與時間關系如下列所示:
| 0 | 5 min | 10 min | 15 min | 20 min | 25 min |
I(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
II(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
相對實驗I,實驗II可能改變的條件可能是 ,該溫度下,平衡常數= 。
②若開始向絕熱容器中投入一定量二氧化碳、氫氣在一定條件下發生上述可逆反應。
下列圖像正確且說明可逆反應達到平衡狀態的是 。(填序號)
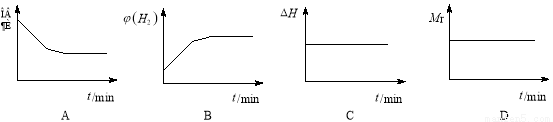
查看答案和解析>>
科目:高中化學 來源:2015屆湖北省高三上學期起點考試化學試卷(解析版) 題型:選擇題
類比推理的方法在化學學習與研究中有廣泛的應用,但有時會得出錯誤的結論。以下幾種類比推理結論中正確的是( )
A.H2SO4為強酸,推出HClO4為強酸
B.Fe3Cl8可以改寫為FeCl2·2FeCl3,推出Fe3I8可以改寫為FeI2·2FeI3
C.NH3的沸點高于PH3,推出CH4沸點高于SiH4
D.CO2通入Ba(NO3)2溶液中無沉淀生成,推出SO2通入Ba(NO3)2溶液中無沉淀生成
查看答案和解析>>
科目:高中化學 來源:2015屆湖北省高三上學期起點考試化學試卷(解析版) 題型:選擇題
化學與生活、社會密切相關。下列說法不正確的是( )
A.光導纖維導電能力很強,是一種很好的通訊材料
B.純堿不僅有較強的去油污能力,還可以用于中和發酵面團中的酸性物質
C.煤的氣化和液化都屬于化學變化
D.鈦被譽為“太空金屬”,室溫下不與水、稀硫酸、稀硝酸反應,卻溶于氫氟酸,可能是因為氟離子易與鈦離子形成可溶性難電離物質
查看答案和解析>>
科目:高中化學 來源:2015屆湖北省孝感市七校聯考高二下學期期中考試化學試卷(解析版) 題型:選擇題
已知X、Y元素同周期,且電負性X>Y,下列說法錯誤的是
A.X與Y形成化合物時,X顯負價,Y顯正價
B.第一電離能Y一定小于X
C.最高價含氧酸的酸性:X對應的酸性強于Y對應的酸性
D.氣態氫化物的穩定性:HmY小于HmX
查看答案和解析>>
科目:高中化學 來源:2015屆浙江省溫州市十校聯合體高三上學期期初聯考化學試卷(解析版) 題型:填空題
(12分)甲醇可作為燃料電池的原料。以CH4和H2O為原料,通過下列反應來制備甲醇。
I: CH4(g)+H2O(g)=CO(g) + 3H2(g) △H =+206.0 kJ·mol-1
II:CO(g)+2H2(g)=CH3OH (g) △H =-129.0 kJ·mol-1
(1)CH4(g)與H2O(g)反應生成CH3OH (g)和H2(g)的熱化學方程式為 。
(2)將1.0 mol CH4和2.0 mol H2O ( g )通入容積為10 L的反應室,在一定條件下發生反應I,測得在一定的壓強下CH4的轉化率與溫度的關系如下圖。
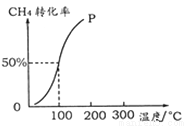
①假設100 ℃時達到平衡所需的時間為5 min,則用H2表示該反應的平均反應速率為 。
②100℃時反應I的平衡常數為 。
(3)在壓強為0.1 MPa、溫度為300℃條件下,將a mol CO與3a mol H2的混合氣體在催化劑作用下發生反應II生成甲醇,平衡后將容器的容積壓縮到原來的l/2,其他條件不變,對平衡體系產生的影響是 (填字母序號)。
A.c ( H2 )減少 B.正反應速率加快,逆反應速率減慢
C.CH3OH 的物質的量增加 D.重新平衡c ( H2 )/ c (CH3OH )減小
E.平衡常數K增大
(4)甲醇對水質會造成一定的污染,有一種電化學法可消除這種污染,其原理是:通電后,將Co2+氧化成Co3+,然后以Co3+ 做氧化劑把水中的甲醇氧化成CO2而凈化。實驗室用下圖裝置模擬上述過程:
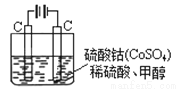
① 寫出陽極電極反應式 。
② 寫出除去甲醇的離子方程式 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com