
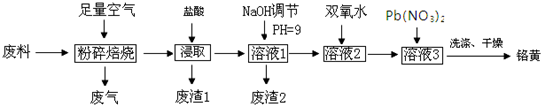
分析 流程分析可知,鉻廢料(主要成分為Cr2O3,雜質為Fe2O3、Al2O3、C、SiO2)為原料粉碎焙燒除去碳,后在反應器中加入濃鹽酸浸取,因二氧化硅不反應,經過濾可得到廢渣Ⅰ為二氧化硅,溶液1中含有Fe3+、Al3+、Cr3+等,加入氫氧化鈉溶液調節pH=9,可除去Fe3+、Al3+,得到的廢渣2為Al(OH)3和Fe(OH)3,在CrO22-溶液2中加入過氧化氫,經氧化可得到CrO42-溶液,然后加入Pb(NO3)2溶液,可得到PbCrO4沉淀,
(1)將鉻污泥粉碎可以增大與鹽酸的接觸面積,有利于提高浸取率;
(2)上述分析可知,濾渣1的主要成分是二氧化硅;
(3)Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)=4×10-38,溶液PH=9鐵濾渣沉淀完全,據此計算;
(4)Cr2O3與氧氣不反應,化學性質與氧化鋁類似,Cr2O3 與強堿溶液反應生成NaCrO2;
(5)由流程圖可知,加入30%H2O2的目的是在堿性條件下將CrO2-氧化為CrO42-,同時生成水;
(6)檢驗沉淀是否完全的方法是:取最后一次洗滌液,滴加AgNO3溶液,無沉淀生成,說明沉淀完全.
解答 解:鉻廢料(主要成分為Cr2O3,雜質為Fe2O3、Al2O3、C、SiO2)為原料粉碎焙燒除去碳,后在反應器中加入濃鹽酸浸取,因二氧化硅不反應,經過濾可得到廢渣Ⅰ為二氧化硅,溶液1中含有Fe3+、Al3+、Cr3+等,加入氫氧化鈉溶液調節pH=9,可除去Fe3+、Al3+,得到的廢渣2為Al(OH)3和Fe(OH)3,在CrO22-溶液2中加入過氧化氫,經氧化可得到CrO42-溶液,然后加入Pb(NO3)2溶液,可得到PbCrO4沉淀,
(1)將鉻污泥粉碎可以增大與鹽酸的接觸面積,加快反應速率,有利于提高浸取率,故答案為:增加反應物間的接觸面積,加快反應速率;
(2)濾渣1的主要成分是二氧化硅,故答案為:SiO2;
(3)Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)=4×10-38,調節溶于PH=9,c(OH-)=10-5mol/L,則在溶液1殘留的c(Fe3+)=$\frac{Ksp}{{c}^{3}(O{H}^{-})}$=$\frac{4×1{0}^{-38}}{(1{0}^{-5})^{3}}$=4×10-23mol/L,
故答案為:4×10-23mol/L;
(4)Cr2O3與氧氣不反應,化學性質與氧化鋁類似,Cr2O3 與強堿溶液反應生成NaCrO2,反應的離子方程式為:Cr2O3+2OH-=2CrO2-+H2O,
故答案為:Cr2O3+2OH-=2CrO2-+H2O;
(5)由流程圖可知,加入30%H2O2的目的是在堿性條件下將CrO2-氧化為CrO42-,同時生成水,反應離子方程式為3H2O2+2CrO2-+2OH-=2CrO42-+4H2O;
故答案為:3H2O2+2CrO2-+2OH-=2CrO42-+4H2O;
(6)檢驗鉻黃洗滌干凈的操作方法是:取最后的一次洗滌液,滴加AgNO3溶液,無沉淀生成,說明沉淀完全;
故答案為:取最后洗滌液少量于試管中,滴加硝酸銀溶液,若不出現白色沉淀,則洗滌干凈.
點評 本題考查物質的分離、提純的綜合應用,為高考常見題型,側重于學生的分析能力和實驗能力的考查,本題注重溶度積常數的計算、離子的檢驗、氧化還原反應等知識點,難度不大,離子的檢驗是高考的熱點,注意離子方程式的書寫.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K+、Al3+、CO32-、Cl- | B. | Na+、H+、SO42-、SiO32- | ||
| C. | H+、NH4+、SO42-、I- | D. | H+、Fe2+、Cl-、ClO- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 初始濃度/(mol•L-1) | 初始速率/mol•L-1s-1 | |
| c(NO) | c(O2) | |
| 0.010 | 0.010 | 2.5×10-3 |
| 0.010 | 0.020 | 5.0×10-1 |
| 0.030 | 0.020 | 4.5×10-2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 容器編號 | 溫度(℃) | 起始物質的量(mol) | 平衡物質的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | |||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加水稀釋 | B. | 加少量NaOH溶液 | C. | 降低溫度 | D. | 鋅片改為鋅粉 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
. .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com