
| A. | 澄清石灰水與過量碳酸氫鈉溶液反應:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 硫酸氫鈉碳酸氫鈉溶液中加入氫氧化鋇溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+2H2O | |
| C. | 向氫氧化鈉溶液中通入足量CO2+2OH-+CO2?CO32-+H2O | |
| D. | 向氫氧化鋇溶液中加入過量硫酸:2H++SO42-+Ba2++2OH-?BaSO4↓+2H2O |
分析 A.碳酸氫鈉過量,反應生成碳酸鈣沉淀和碳酸鈉,反應產物中碳酸根離子有剩余;
B.反應后溶液呈中性,則碳酸氫鈉與氫氧化鋇按照物質的量2:1反應;
C.二氧化碳足量,反應生成碳酸氫鈉;
D.氫氧化鋇與硫酸反應生成硫酸鋇沉淀和水.
解答 解:A.澄清石灰水與過量碳酸氫鈉溶液反應,離子方程式按照氫氧化鈣的化學式組成書寫,正確的離子方程式為:2HCO3-+Ca2++2OH-═CO32-+CaCO3↓+2H2O,故A錯誤;
B.硫酸氫鈉溶液中加入氫氧化鋇溶液至中性,反應生成硫酸鋇沉淀和水,正確的離子方程式為:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故B錯誤;
C.向氫氧化鈉溶液中通入足量CO2,反應生成碳酸氫鈉,正確的離子方程式為:OH-+CO2?HCO3-,故C錯誤;
D.向氫氧化鋇溶液中加入過量硫酸,反應的離子方程式為:2H++SO42-+Ba2++2OH-?BaSO4↓+2H2O,故D正確;
故選D.
點評 本題考查了離子方程式的正誤判斷,為高考的高頻題,屬于中等難度的試題,注意掌握離子方程式的書寫原則,明確離子方程式正誤判斷常用方法:檢查反應能否發生,檢查反應物、生成物是否正確,檢查各物質拆分是否正確,如難溶物、弱電解質等需要保留化學式,檢查是否符合守恒關系(如:質量守恒和電荷守恒等)、檢查是否符合原化學方程式等.


科目:高中化學 來源: 題型:解答題
| a | b | ||
| x | y | z |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
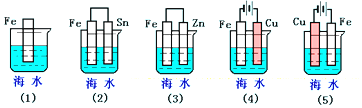
| A. | (5)(2)(1)(3)(4) | B. | (2)(5)(3)(4)(1) | C. | (5)(3)(4)(1)(2) | D. | (1)(5)(3)(4)(2) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫氣在氯氣中安靜燃燒,發出蒼白色火焰,瓶口出現的“霧氣”是鹽酸小液滴 | |
| B. | 漂白粉溶液中滴入少量鹽酸,可增強其漂白效果 | |
| C. | 鈉在空氣中燃燒,產生黃色火焰,生成白色的Na2O的固體 | |
| D. | 鐵絲在氯氣中燃燒,生產棕紅色的煙,氯化鐵的水溶液呈黃色 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 過氧化鈉加入到紫色石蕊試液中,紫色石蕊先變紅后褪色且有氣泡產生 | |
| B. | 冷的濃硫酸和濃硝酸都可以用鋁、鐵的容器盛裝 | |
| C. | 硅、氯、硫、氮、鈉元素在自然界只有化合態沒有游離態 | |
| D. | 濃硝酸有氧化性,稀硝酸沒有氧化性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶于水能導電,屬于電解質 | |
| B. | 使品紅溶液褪色,有漂白性 | |
| C. | 使酸性高錳酸鉀溶液褪色,有還原性 | |
| D. | 能殺菌、消毒,可按照國家標準用作食物的防腐劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 編號 | 實驗內容 | 實驗目的 |
| A | 向含有酚酞的Na2CO3溶液中加入少量BaC12固體,溶液紅色變淺 | 證明Na2CO3溶液中存在水解平衡 |
| B | 室溫下,用pH試紙分別測定濃度為18mol/L和0.1mol/L H2SO4溶液的pH | 比較不同濃度H2SO4的酸性強弱 |
| C | 配制FeCl2溶液時,先將FeCl2溶于適量濃鹽酸中,再用蒸餾水稀釋到所需濃度,最后在試劑瓶中加入少量銅粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
| D | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/LMgCl2溶液,產生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成紅褐色沉淀 | 證明在相同溫度下的Ksp>Ksp |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com