
| A. | 反應(1)和(2)均為氧化還原反應 | |
| B. | 反應(1)的氧化劑是O2,還原劑是FeO•Cr2O3 | |
| C. | 高溫下,O2的氧化性大于Fe2O3小于Na2CrO4 | |
| D. | 生成1mol的Na2Cr2O7時共轉移5mol電子 |
分析 A、化學反應中有元素化合價變化的反應是氧化還原反應,沒有化合價變化的化學反應不是氧化還原反應;
B、得電子化合價降低的物質是氧化劑,失電子化合價升高的物質是還原劑;
C、同一化學反應中氧化劑的氧化性大于氧化產物的氧化性;
D、反應只有O元素的化合價降低,由0價降低為-2價,電子轉移的物質的量為參加反應的氧氣的物質的量的4倍,由方程式可知計算Na2CrO4與轉移電子數,再換算為生成1mol的Na2Cr2O7時轉移電子數.
解答 解:A、4FeO•Cr2O3+8Na2CO3+7O2$\frac{\underline{\;高溫\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2中有元素化合價的變化,所以是氧化還原反應,而2Na2CrO4+H2SO4$\frac{\underline{\;高溫\;}}{\;}$Na2SO4+Na2Cr2O7+H2O中沒有元素化合價的變化,所以不是氧化還原反應,故A錯誤;
B、4FeO•Cr2O3+8Na2CO3+7O2$\frac{\underline{\;高溫\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2中,氧氣中氧元素得電子化合價降低,所以氧化劑是氧氣,鐵元素和鉻元素失電子化合價升高,所以還原劑是FeO•Cr2O3,故B正確;
C、4FeO•Cr2O3+8Na2CO3+7O2$\frac{\underline{\;高溫\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2中,氧化劑是氧氣,還原劑是FeO•Cr2O3,所以氧氣的氧化性大于Na2CrO4和Fe2O3,但不能判斷Na2CrO4和Fe2O3的氧化性相對強弱,故C錯誤;
D、由方程式4FeO•Cr2O3+8Na2CO3+7O2$\frac{\underline{\;高溫\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2轉移電子可知,生成1molNa2CrO4時,參加反應的O2的物質的量為$\frac{7}{8}$mol,反應中O元素由0價降低為-2價,電子轉移的物質的量為參加反應的氧氣的物質的量的4倍,轉移電子的物質的量為$\frac{7}{8}$mol×4=3.5mol,所以反應(1)中每生成1molNa2CrO4時電子轉移3.5mol,反應(2)不是氧化還原反應,所以生成1mol的Na2Cr2O7時轉移7mol電子,故D錯誤;
故選B.
點評 本題考查了氧化劑和還原劑的判斷、氧化還原反應的判斷等知識點,根據元素化合價的變化判斷氧化還原反應、氧化劑和還原劑即可分析解答本題.


科目:高中化學 來源: 題型:選擇題
| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+、H+、SO32-、NO3- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、Fe3+、NO3-、OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
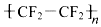 )的材料.
)的材料.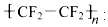 是不粘鍋涂覆物質的主要成分.下列有關說法不正確的是( )
是不粘鍋涂覆物質的主要成分.下列有關說法不正確的是( )| A. | CF2=CF2能使溴的CCl4溶液褪色 | |
| B. | 四氟乙烯合成聚四氟乙烯屬于加聚反應 | |
| C. | 1molCF2=CF2只能與1molH2發生加成反應 | |
| D. | 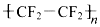 能使高錳酸鉀酸性溶液褪色 能使高錳酸鉀酸性溶液褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃的強酸和稀的強堿反應 | B. | 濃的弱酸和稀的強堿反應 | ||
| C. | 等濃度的強酸和弱堿反應 | D. | 二元強酸與一元強堿反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將濃硫酸轉移至容量瓶中,加水稀釋至距標線2~3 cm處,改用膠頭滴管定容 | |
| B. | 用酒精萃取碘水中的碘單質 | |
| C. | 進行液體蒸餾實驗時,冷凝管中應充滿自來水 | |
| D. | 某溶液加入鹽酸酸化的氯化鋇溶液后,出現白色沉淀,則原溶液中必有SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ③>②>① | B. | ②>③>① | C. | ①>②>③ | D. | ③>①>② |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 10 | B. | 50 | C. | 5×l03 | D. | 104 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 當x≤n時,反應的離子方程式為:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 當x≥$\frac{3n}{2}$時,反應的離子方程式為:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| C. | 當n≤x≤$\frac{3n}{2}$時,反應中轉移電子的物質的量n(e-)為2nmol≤n(e-)≤3nmol | |
| D. | 當n<x<$\frac{3n}{2}$時,溶液中Fe3+、Cl-、I2的物質的量之比為2(x-n):x:n |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c(CH3COO-)>c(Ba2+)>c(OH-)>c(H+) | B. | c(H+)+c(Ba2+)=c(CH3COO-)+c(OH-) | ||
| C. | c(OH-)═c(H+)+c(CH3COO-) | D. | 2c(Ba2+)=c(CH3COO-)+c(CH3COOH) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com