
| 42 |
| 42×2 |
| 82 |
| 82×4 |
| 52 |
| 52×3 |
| 1 |
| 3 |


科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
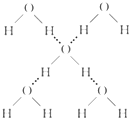 水是生命之源,它與我們的生活密切相關.在化學實驗和科學研究中,水也是一種常用的試劑.
水是生命之源,它與我們的生活密切相關.在化學實驗和科學研究中,水也是一種常用的試劑.| 分子 | H2O | H2S |
| 中心原子雜化方式 | sp3 | |
| 鍵角 | 104.5° | 92.1° |
| 鍵長 | 95.7pm | 133.6pm |
查看答案和解析>>
科目:高中化學 來源: 題型:
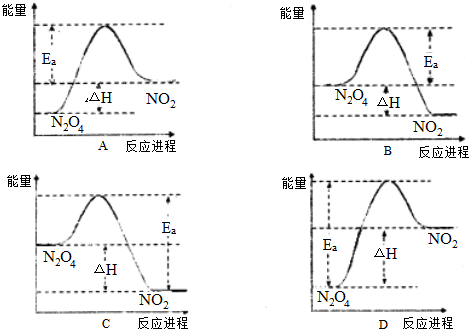
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com