
分析 (1)氯氣是氣體,不便保存和運輸;氯氣和氫氧化鈣反應生成氯化鈣、次氯酸鈣和水;
(2)有電子轉移的化學反應是氧化還原反應;
(3)次氯酸鈣和稀鹽酸發生復分解反應,和濃鹽酸發生氧化還原反應;
(4)濃鹽酸易揮發,次氯酸鈣能夠與空氣中的二氧化碳、水反應生成碳酸鈣和次氯酸,次氯酸分解生成氯化氫和氧氣,鹽酸與碳酸鈣反應生成二氧化碳氣體,據此解答.
解答 解:(1)氯氣是氣體,不便保存和運輸,將氣體轉化為較穩定固體物質便于保存和運輸,所以工業上將氯氣制成漂粉精;
工業上將氯氣通入石灰乳[Ca(OH)2]制取漂粉精,化學反應方程式為:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;故答案為:便于保存和運輸,2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(2)A.生石灰在空氣中久置變質,發生CaO+H2O═Ca(OH)2,Ca(OH)2+CO2═CaCO3↓+H2O,均屬于非氧化還原反應,故A錯誤;
B.漂白粉空氣中久置,先發生CO2+H2O+Ca(ClO)2═CaCO3+2HClO,屬于非氧化還原反應,后發生2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,屬于氧化還原反應,故B正確;
C.氫氧化鈉和二氧化碳發生反應2NaOH+CO2═Na2CO3+H2O,屬于非氧化還原反應,故C錯誤;
D.亞硫酸鈉易被氧氣氧化生成硫酸鈉,反應方程式為:Na2SO3+O2=Na2SO4,屬于氧化還原反應,故D錯誤;
故選B;
(3)漂白粉和稀鹽酸發生的化學反應方程式為:Ca(ClO)2+2HCl=CaCl2+2HClO,屬于復分解反應;
漂白粉和濃鹽酸發生的化學反應為:Ca(ClO)2+4HCl(濃)=CaCl2+Cl2↑+2H2O,該反應屬于氧化還原反應,
故答案為:Ca(ClO)2+2HCl=CaCl2+2HClO,復分解反應;Ca(ClO)2+4HCl(濃)=CaCl2+2Cl2↑+2H2O,氧化還原反應;
(4)次氯酸鈣能夠與空氣中的二氧化碳、水反應生成碳酸鈣和次氯酸,次氯酸分解生成氯化氫和氧氣,貯存很久的漂白粉可能存在碳酸鈣,貯存很久的漂白粉可能存在碳酸鈣,加鹽酸發生Ca(ClO)2+4HCl(濃)=CaCl2+2Cl2↑+2H2O、CaCO3+2HCl=CaCl2+CO2↑+H2O,
濃鹽酸易揮發,從溶液中生成的氣體中會混有水蒸氣,則制得的氯氣中,可能含有雜質氣體為CO2、HCl、H2O(氣),
故選:①③④.
點評 本題考查氯氣的化學性質,從反應原理來理解氯氣的性質,注意漂白粉和濃稀鹽酸反應的區別,為易錯點.


 同步練習強化拓展系列答案
同步練習強化拓展系列答案科目:高中化學 來源: 題型:選擇題
| A. | 12C與14C為不同核素 | |
| B. | 石墨和C60的互為同素異形體 | |
| C. | H2O和D2O互為同位素 | |
| D. | 氨基酸分子中均含有羧基(-COOH)和氨基(-NH2) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
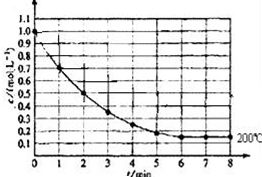 一固定體積的密閉容器中放入1molX(g)發生反應:X(g)?4Y(s)+Z(g),如圖表示在 200℃時,X的濃度隨時間變化的曲線.
一固定體積的密閉容器中放入1molX(g)發生反應:X(g)?4Y(s)+Z(g),如圖表示在 200℃時,X的濃度隨時間變化的曲線.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 7.2 g CaO2晶體中陰離子和陽離子總數為0.3 NA | |
| B. | 在標況下,22.4LHF和22.4LC2H4原子個數比為1:3 | |
| C. | 將1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+數目為NA | |
| D. | 0.1 mol H2O2分子中含極性共價鍵數目為0.3 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A | B | C | D |
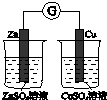 | 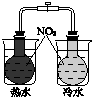 | 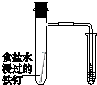 | 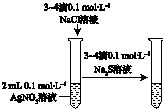 |
| 驗證化學能轉化為電能 | 證明溫度對平衡移動的影響 | 驗證鐵發生析氫腐蝕 | 驗證AgCl溶解度小于Ag2S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
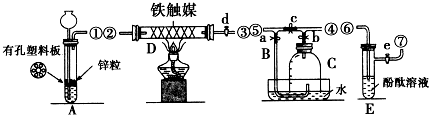
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .其最高價氧化物對應水化物的堿性比Mg(OH)2強(填“強”或“弱”).
.其最高價氧化物對應水化物的堿性比Mg(OH)2強(填“強”或“弱”).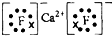 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ③C的化學式為C15H13NO4,-Bn含苯環但不含甲基.
③C的化學式為C15H13NO4,-Bn含苯環但不含甲基.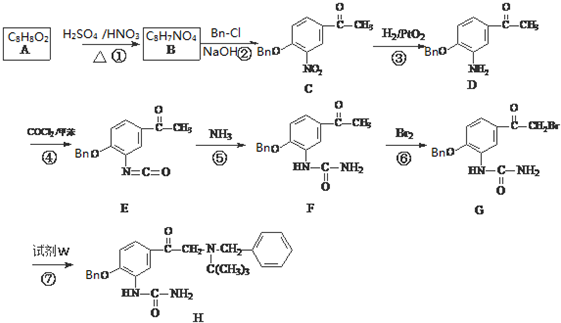
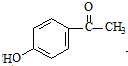 W
W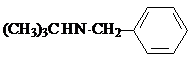 .
.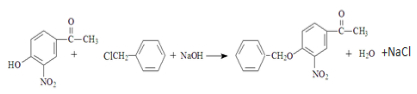 .
.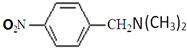 (無機試劑任用)
(無機試劑任用)查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com