
 .其最高價氧化物對應水化物的堿性比Mg(OH)2強(填“強”或“弱”).
.其最高價氧化物對應水化物的堿性比Mg(OH)2強(填“強”或“弱”).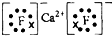 .
.分析 (1)Ca的原子序數為20,結合原子核外電子排布畫出原子結構示意圖,金屬性越強,對應的最高價氧化物水化物堿性越強;
(2)最活潑的非金屬元素為F,再確定該化合物的化學式,根據電子式書寫規則寫出電子式;
(3)根據得失電子數相等配平方程式;
(4)Fe和稀鹽酸反應生成氯化亞鐵,亞鐵離子不穩定,能被雙氧水氧化生成鐵離子,雙氧水被還原生成水;
(5)鈣與水反應生成氫氧化鈣與氫氣,根據n=$\frac{V}{{V}_{m}}$計算氫氣的物質的量,根據電子轉移守恒計算Ca的物質的量,根據氧化鈣的質量分數計算氧化鈣的質量,計算氧化鈣的物質的量,氧化鈣與水反應生成氫氧化鈣,氫氧化鈣與二氧化碳反應生成碳酸鈣,根據鈣元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO),再根據m=nM計算碳酸鈣的質量.
解答 解:(1)Ca是20號元素,元素的原子序數=其核外電子數=核內質子數,其核外電子排布是2,8,8,2,所以其原子結構示意圖為 ,金屬性Ca>Mg,則Ca(OH)2堿性比Mg(OH)2強,故答案為
,金屬性Ca>Mg,則Ca(OH)2堿性比Mg(OH)2強,故答案為 ;強;
;強;
(2)元素周期表中最活潑的非金屬元素是F元素,與Ca形成化合物離子化合物D,所以D是CaF2,其電子式為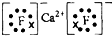 ,
,
故答案為: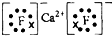 ;
;
(3)該方程式中元素的化合價變化為:P→Ca3(PO4)2,磷元素由0價→+5價,一個磷原子失5個電子;FeO→Fe,鐵元素由+2價→0價,一個 FeO得2個電子,根據氧化還原反應中得失電子數相等,所以其最小公倍數為10,故 P的計量數為2,FeO的計量數為5,其它元素根據原子守恒配平,所以該方程式為2 P+5FeO+3CaO$\frac{\underline{\;高溫\;}}{\;}$Ca3(PO4)2+5Fe,
故答案為:2;5;3;1;5Fe;
(4)金屬鈣線中含鐵,Fe和稀鹽酸反應生成氯化亞鐵,亞鐵離子不穩定,能被雙氧水氧化生成鐵離子,雙氧水被還原生成水,離子方程式為2Fe2++H2O2+2H+═2Fe3++2 H2O,故答案為:2Fe2++H2O2+2H+═2Fe3++2 H2O;
(5)448mlH2的物質的量為$\frac{0.448L}{22.4L/mol}$=0.02mol,鈣與水反應生成氫氧化鈣與氫氣,根據電子轉移守恒可知,Ca的物質的量為$\frac{0.02mol×2}{2}$=0.02mol,樣品中CaO質量分數為3.5%,故氧化鈣的質量為3.2g×3.5%=0.112g,故氧化鈣的物質的量為$\frac{0.112g}{56g/mol}$=0.002mol,氧化鈣與水反應生成氫氧化鈣,氫氧化鈣與二氧化碳反應生成碳酸鈣,根據鈣元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO)=0.02mol+0.002mol=0.022mol,碳酸鈣的質量為0.022mol×100g/mol=2.2g,
故答案為:2.2.
點評 本題考查金屬及化合物的性質及綜合應用,為高頻考點,把握原子結構與性質,物質的性質及氧化還原反應等為解答的關鍵,側重分析與應用能力的考查,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 將飽和FeCl3溶液逐滴滴加到NaOH溶液中,即可制得Fe(OH)3膠體 | |
| B. | FeCl3溶液是電中性的,Fe(OH)3膠體是帶正電荷的 | |
| C. | 可利用丁達爾現象區別FeCl3溶液和Fe(OH)3膠體 | |
| D. | 將500mL 2mol/L FeCl3溶液制成膠體,膠粒的數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 糖原與纖維素互為同分異構體,與淀粉互為同系物 | |
| B. | 糖原能溶于水,有甜味 | |
| C. | 糖原水解的最終產物是葡萄糖 | |
| D. | 糖原具有還原性,是還原性糖 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的數目為NA | |
| B. | 常溫常壓下,14 g由N2與CO組成的混合氣體含有的原子數目為NA | |
| C. | 常溫常壓下,Na2O2與足量H2O反應,共生成0.2 mol O2,轉移電子的數目為0.8NA | |
| D. | 標準狀況下,2.24 L已烷含有分子的數目為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 世博會前期,凈化自來水時加入ClO2作為消毒劑 | |
| B. | 世博會期間,利用可降解的“玉米塑料”替代一次性飯盒,可防止產生白色污染 | |
| C. | 世博停車場安裝催化光解設施,可將汽車尾氣中的CO和NO反應生成無毒氣體 | |
| D. | 世博會中國館一“東方之冠”使用的鋼筋混凝土屬于高分子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向某溶液中加入Ba(NO3)2溶液和稀HNO3,有白色沉淀產生,則溶液中一定含有SO42- | |
| B. | 氯氣和二氧化硫濕潤時均有漂白作用,若將二者等物質的量混合溶于水,漂白效果會增強 | |
| C. | 將稀硫酸滴到淀粉碘化鉀試紙上,一段時間后變藍,有反應4H++4I-+O2=2I2+2H2O發生 | |
| D. | 將足量的CO2逐漸通入含等物質的量的Ba(OH)2和KOH的混合溶液中,生成沉淀的物質的量與CO2的關系如圖: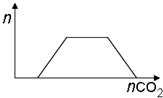 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
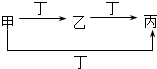 ( )
( )| 甲 | 乙 | 丙 | 丁 | |
| A | S | SO2 | SO3 | O2 |
| B | CO32- | HCO3- | CO2 | H+ |
| C | Cl2 | FeCl3 | FeCl2 | Fe |
| D | Al3+ | Al(OH)3 | AlO2- | NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
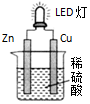
| A. | 鋅是負極,電子從鋅片經導線流向銅片 | |
| B. | 氫離子在銅片表面被還原 | |
| C. | 鋅質量減少65g時,銅電極表面析出氫氣是22.4L | |
| D. | 裝置中存在“化學能→電能→光能”的轉換 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com