
 研究NO2、SO2、CO等大氣污染氣體的處理具有重要意義.
研究NO2、SO2、CO等大氣污染氣體的處理具有重要意義.
| ||
| △ |
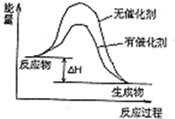 ,故答案為:
,故答案為: ;
;| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 4 |
| 5 |
| 8 |
| 3 |


 名校通行證有效作業(yè)系列答案
名校通行證有效作業(yè)系列答案科目:高中化學(xué) 來源: 題型:
| A、是電解質(zhì) |
| B、存在離子 |
| C、存在電子 |
| D、存在自由移動的離子 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
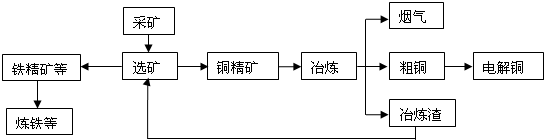
| ||
| 物 質(zhì) | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| Ksp | 8.0×10-16 | 4.0×10-38 | 3.0×10-17 | 2.2×10-20 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
| A、Al2O3可與水反應(yīng)生成Al(OH)3 |
| B、鋁是人類使用最早的金屬之一 |
| C、Al2O3是堿性氧化物 |
| D、Al(OH)3沉淀可以溶于鹽酸 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
| A、Na+、SiO32-、NO3-、CO32- |
| B、K+、Cl-、MnO4-、SO42- |
| C、Na+、NO3-、SO42-、HCO3- |
| D、Na+、SO42-、NH4+、Cl- |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
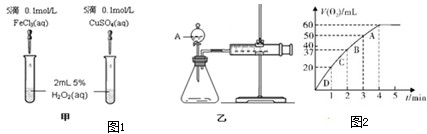
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
 硫酸亞鐵銨[(NH4)2SO4?FeSO4?6H2O]為淺綠色晶體,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小.實驗室中常以廢鐵屑為原料來制備,其步驟如下:
硫酸亞鐵銨[(NH4)2SO4?FeSO4?6H2O]為淺綠色晶體,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小.實驗室中常以廢鐵屑為原料來制備,其步驟如下:查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
 低碳經(jīng)濟呼喚新能源和清潔環(huán)保能源.煤化工中常需研究不同溫度下的平衡常數(shù)、投料比及熱值等問題.
低碳經(jīng)濟呼喚新能源和清潔環(huán)保能源.煤化工中常需研究不同溫度下的平衡常數(shù)、投料比及熱值等問題.| 溫度/℃ | 400 | 500 | 850 |
| 平衡常數(shù) | 9.94 | 9 | 1 |
| 時間(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3[m] |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com