
| A. | 為避免船體遭受腐蝕,在船舶的外殼裝上若干鋅塊,稱為犧牲陽極的陰極保護法 | |
| B. | 原電池工作時,電流的方向由正極→負載→負極→原電池中電解質溶液→正極 | |
| C. | 純銀在空氣中久置變黑發生的是化學腐蝕 | |
| D. | 在鐵制品上鍍銅時,鐵制品作電鍍池的陽極,銅鹽為電鍍液 |
分析 A.鋅、鐵和海水構成原電池,鋅為負極,被消耗,鐵為正極,被保護;
B.原電池工作時負極失去電子,電流由正極經外電路流向負極,原電池中電解質溶液流向正極;
C.因在空氣中發生化學腐蝕,生成硫化銀;
D.鍍銅時,Cu為陽極,失去電子.
解答 解:A.作原電池負極的金屬加速被腐蝕,作原電池正極的金屬被保護,鋅、鐵和海水構成原電池,鋅作負極,鐵作正極被保護,該保護方法為犧牲陽極的陰極保護法,故A正確;
B.電流的方向與電子的運動方向相反,原電池工作時電流由正極經外電路流向負極,原電池中電流流向為電解質溶液到正極,故B正確;
C.純銀在空氣中久置變黑發生化學腐蝕,生成硫化銀,故C正確;
D.鍍銅時,Cu為陽極,失去電子,而鐵制品作電鍍池的陰極,銅鹽為電鍍液,故D錯誤;
故選D.
點評 本題考查了原電池和電解池的原理,題目難度不大,明確原電池中正負極的判斷方法和電解原理以及電流的移動是解題關鍵,側重于考查學生的分析能力和對基礎知識的應用能力.


 習題精選系列答案
習題精選系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol乙烯與Cl2完全加成,然后與Cl2發生取代反應,共消耗氯氣5mol | |
| B. | 溴水遇到乙醛溶液出現褪色現象,是因為它們發生了氧化反應 | |
| C. | 乙烯與苯都能使溴水褪色,但褪色原理不同 | |
| D. | 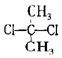 與 與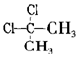 互為同分異構體 互為同分異構體 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 還原劑中必定有元素化合價升高被氧化 | |
| B. | 通電后,氫氧化鐵膠體向陰極運動 | |
| C. | 物質所含元素化合價升高的反應叫還原反應 | |
| D. | 膠體與其他分散系的本質區別是可以發生丁達爾效應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1molNa2O2晶體中共含有4NA個離子 | |
| B. | 0.1mol AlCl3完全水解轉化為氫氧化鋁膠體,生成0.1NA個膠粒 | |
| C. | 常溫常壓下16gO2和O3混合氣體含有NA個氧原子 | |
| D. | 1mol/LNa2CO3溶液中含有NA個CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com