
分析 分析操作對溶質的物質的量n和溶液體積V的影響,依據$\frac{n}{V}$凡是使n偏小或者使V偏大的操作,都會導致溶液濃度偏低,反之導致溶液濃度偏高.
解答 解:①用量筒量取濃硫酸時,俯視讀數,導致溶液體積偏小,所配溶液濃度偏大;
②濃硫酸稀釋后未冷卻到室溫就注入容量瓶定容,冷卻后,溶液體積偏小,所配溶液濃度偏大;
③定容時,俯視刻度線,導致溶液體積偏小,溶液濃度偏大;
④配制好的溶液轉移入試劑瓶時,部分液體迸濺,導致溶質的物質的量偏小,溶液濃度偏小;
故答案為:偏大;偏大;偏大;偏小.
點評 本題考查了一定物質的量濃度溶液的配制誤差分析,依據C=$\frac{n}{V}$,準確把握操作對溶質的物質的量和溶液體積的影響是解題關鍵,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 高溫下,16.8g Fe與足量水蒸氣完全反應失去電子數為0.8NA | |
| B. | 一定條件下Fe粉與足量的濃硫酸反應,轉移電子數為3NA | |
| C. | 1.8g重水(D2O)中含有的質子數和電子數均為NA | |
| D. | 標準狀況下,22.4L NO 和22.4L O2混合后所得氣體中分子總數為1.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
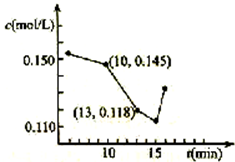 對低品位的菱鎂礦(主要成份是MgCO3和CaCO3)的綜合利用意義重大.礦石經煅燒、消化后得到鈣鎂的氫氧化物,再經過碳化實現Ca2+、Mg2+的分離.碳化反應的化學方程式如下:
對低品位的菱鎂礦(主要成份是MgCO3和CaCO3)的綜合利用意義重大.礦石經煅燒、消化后得到鈣鎂的氫氧化物,再經過碳化實現Ca2+、Mg2+的分離.碳化反應的化學方程式如下:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,其中S原子軌道的雜化類型是sp3,它是極性(填“極性”或“非極性”)分子.
,其中S原子軌道的雜化類型是sp3,它是極性(填“極性”或“非極性”)分子.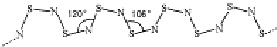
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | CH2=CH3 | B. | CH2=CH-CH2OH | C. | CH3=CH-COOH | D. | CH2=CH-COOCH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 稀鹽酸滴在銅片上:Cu+2H+═Cu2++H2↑ | |
| B. | 氧化鎂與稀鹽酸混合:MgO+2H+═Mg2++H2O | |
| C. | 石灰石上滴加稀鹽酸:CaCO3+2H+═Ca2++H2CO3 | |
| D. | 銅片插入硝酸銀溶液中:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cl-的結構示意圖: | |
| B. | 乙酸的結構示意圖:C2H4O2 | |
| C. | 硫酸的電離方程式:H2SO4═H2++SO42- | |
| D. | 氯化鈉的電子式: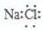 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NO2 | B. | NO | C. | N2 O | D. | N2O3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com