
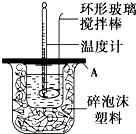
 分別取40mL的0.50mol/L鹽酸與0.55mol/L氫氧化鈉溶液進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.請回答下列問題:
分別取40mL的0.50mol/L鹽酸與0.55mol/L氫氧化鈉溶液進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.請回答下列問題:| 實驗序號 | 起始溫度t1/℃ | 終止溫度t2/℃ | |
| 鹽酸 | 氫氧化鈉 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 3.15℃+3.1℃+3.05℃ |
| 3 |
| 1mol |
| 0.02mol |


 全優點練單元計劃系列答案
全優點練單元計劃系列答案科目:高中化學 來源: 題型:
| A、①②⑤ | B、①③④ |
| C、②④⑤ | D、①③⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:
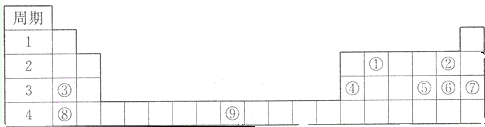
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
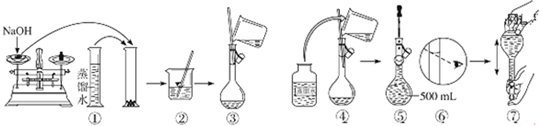
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
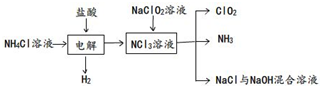
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com