
【題目】某稀硫酸和稀硝酸的混合溶液 200mL,平均分成兩份。向其中一份中逐漸加入銅粉,最多能溶解9.6 g。向另一份中逐漸加入鐵粉,產(chǎn)生氣體的量隨鐵粉質(zhì)量增加的變化如下圖所示(已知硝酸只被還原 為 NO 氣體)。下列分析或結(jié)果錯誤的是( )
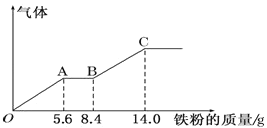
A.第二份溶液中最終溶質(zhì)為FeSO4
B.OA 段產(chǎn)生的是 NO,AB 段的反應為 Fe+2Fe3+═3Fe2+,BC 段產(chǎn)生氫氣
C.原混合酸中HNO3 的物質(zhì)的量為 0.8mol
D.H2SO4 濃度為 2.5molL-1
【答案】C
【解析】
鐵先與稀硝酸發(fā)生氧化還原反應,過量的鐵再與稀硫酸反應,結(jié)合圖像分析,縱坐標為氣體的量,則OA段發(fā)生反應:Fe+NO3-+4H+===Fe3++NO↑+2H2O,AB段反應為:Fe+2Fe3+===3Fe2+,BC段反應為:Fe+2H+===Fe2++H2↑。
A.根據(jù)上述分析,硝酸全部被還原,溶液中沒有硝酸根,而且最后的是二價鐵,所以第二份溶液中最后的溶質(zhì)為FeSO4,A選項正確;
B.OA段發(fā)生反應:Fe+NO3-+4H+===Fe3++NO↑+2H2O,AB段反應為:Fe+2Fe3+===3Fe2+,BC段反應為:Fe+2H+===Fe2++H2↑,B選項正確;
C.OA段硝酸根完全起氧化作用,Fe — NO3-,因此![]() ,所以原混合溶液中
,所以原混合溶液中![]() ,則HNO3也為0.2mol,C選項錯誤;
,則HNO3也為0.2mol,C選項錯誤;
D.最后所有的鐵都在硫酸亞鐵中,根據(jù)硫酸根守恒,則有![]() ,所以H2SO4的濃度為
,所以H2SO4的濃度為![]() ,D選項正確;
,D選項正確;
答案選C。


科目:高中化學 來源: 題型:
【題目】在120℃、1.01×105Pa時,將3L炔烴和烷烴的混合氣體與相同狀況下的14LO2混合,充分燃燒后,恢復到原來狀態(tài)時,所得氣體的體積是17L。則該混合氣體可能是下列各組中的( )
A.C2H4和C2H6B.C3H4和CH4C.C2H2和CH4D.C4H6和C2H6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
Ⅰ.室溫下,現(xiàn)有c(H+) 相同的醋酸甲和鹽酸乙:
(1)相同條件下,取等體積的甲乙兩溶液,各稀釋100倍。稀釋后的溶液,其c(H+) 大小關系為:
甲 _____________乙 (填“大于”“小于”或“等于”,下同)。
(2)各取25 mL的甲乙兩溶液,分別與等濃度的NaOH稀溶液完全反應,則消耗的NaOH溶液的體積大小關系為V(甲) _____________ V(乙)。
Ⅱ.已知25 ℃時有關弱酸的電離平衡常數(shù)如下:
弱酸化學式 | HSCN | CH3COOH | HCN | H2CO3 |
電離平衡常數(shù) | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
(1)25 ℃時,將20 mL 0.1 mol·L-1 CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分別與20 mL 0.1 mol·L-1 NaHCO3溶液混合,實驗測得產(chǎn)生的氣體體積(V)隨時間(t)的變化如圖所示:
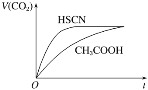
反應初始階段兩種溶液產(chǎn)生CO2氣體的速率存在明顯差異的原因是 _____________。
(2)若保持溫度不變,在醋酸溶液中通入一定量氨氣,下列各量會變小的是 ______________(填字母)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸電離平衡常數(shù)
III.(1)HClO4H2SO4HCl和HNO3都是強酸,其酸性在水溶液中差別不大。以下是某溫度下這四種酸在冰醋酸中的電離常數(shù),下列說法不正確的是 _________。
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | Ka1:6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
A.溫度會影響這四種酸在冰醋中的電離常數(shù)
B.在冰醋酸中HClO4是這四種酸中最強的酸
C.在冰醋酸中H2SO4的電離方程式為H2SO4===2H++SO42-
D.這四種酸在冰醋酸中都沒有完全電離,但仍屬于強電解質(zhì)
(2)亞磷酸是二元中強酸,25 ℃時亞磷酸(H3PO3)的電離常數(shù)為K1=1×10-2K2=2.6×10-7。
①試從電離平衡移動的角度解釋K1為什么比K2大_______________________ 。
②寫出亞磷酸的電離方程式(2步)_________________;_______________ 。
③請設計一種方案,使之能通過直觀的實驗現(xiàn)象判斷醋酸的酸性強于H2S,該方案所用的試劑是 __________,反應的化學方程式為 _____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:25℃時,Ksp[Zn(OH)2]=1.0×10-18,Ka(HCOOH)=1.0×10-4。該溫度下,下列說法錯誤的是
A. Zn(OH)2溶于水形成的飽和溶液中c(Zn2+)>1.0×10-6 mol·L-l
B. HCOO-的水解常數(shù)為1.0×10-10
C. 向Zn(OH)2懸濁液中加入HCOOH,溶液中c(Zn2+)增大
D. Zn(OH)2+2HCOOH![]() =Zn2++2HCOO-+2H2O的平衡常數(shù)K=100
=Zn2++2HCOO-+2H2O的平衡常數(shù)K=100
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硝酸銀是一種無色晶體,常用于照相、制鏡、印刷、醫(yī)藥等。其水溶液和固體常被保存在棕色試劑瓶中。硝酸銀不穩(wěn)定,受熱分解生成固體、NO2 和 O2 。為了驗證 AgNO3 受熱分解的產(chǎn)物,某同學設計了以下實驗,實驗所用的裝置如圖(圖中加熱、夾持儀器等均略去):
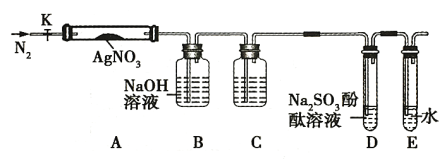
實驗步驟:
a.儀器連接后,放入AgNO3固體之前,關閉K,微熱硬質(zhì)玻璃管A;
b.稱取 AgNO3 固體1.7g 置于A中,先通一段時間N2,再關閉K,用酒精燈加熱硬質(zhì)玻璃管A;
c.待樣品完全分解,裝置A冷卻至室溫,稱量,測得剩余固體的質(zhì)量為1.08 g。
請回答下列問題:
(1)使用酒精燈對AgNO3固體加熱的操作方法是_________________。
(2)步驟a的操作目的是__________________。
(3)步驟b中先通一段時間的N2的目的是_____________________。
(4)裝置C瓶中盛裝的藥品名稱為_____________(合理即可),裝置D中可觀察到的實驗現(xiàn)象為__________________。
(5)根據(jù)實驗現(xiàn)象和稱量結(jié)果,請寫出該裝置中AgNO3固體受熱分解的化學方程式__________________。
(6)從實驗安全角度考慮該裝置存在缺陷,應如何改進?__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將4molA和2molB放入2L密閉容器中發(fā)生反應2A(g)+B(g)![]() 2C(g) △H<0
2C(g) △H<0
,4s后反應達到平衡狀態(tài),此時測得C的濃度為0.6mol/L.下列說法正確的是( )
A.若不斷增加A的質(zhì)量,可使反應放出熱量的數(shù)值達到2︱ΔH︱
B.4 s內(nèi),υ(B)=0.075 mol/(L ·s)
C.達到平衡狀態(tài)后,若只升高溫度,則C的物質(zhì)的量濃度增大
D.達到平衡狀態(tài)后,若溫度不變,縮小容器的體積,則A的轉(zhuǎn)化率降低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳酸二甲酯(CH3OCOOCH3,簡稱DMC)是一種應用前景廣泛的新材料。在密閉容器中按n(CH3OH):n(CO2)=2:1投料直接合成DMC,反應方程式為:2CH3OH(g)+CO2(g)CH3OCOOCH3(g)+H2O(g)。一定條件下,平衡時CO2的轉(zhuǎn)化率如圖所示。下列說法中不正確的是( )
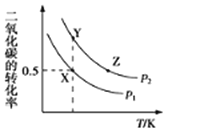
A.該反應的正反應為放熱反應
B.壓強![]()
C.X點對應的平衡常數(shù)為![]()
D.X、Y、Z三點對應的初始反應速率的關系為Z>Y>X
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,體積為10L的密閉容器中,1molX和1molY進行反應:2X(g)+Y(g)Z(g),經(jīng)1min達到平衡,剩余![]() 。下列說法正確的是
。下列說法正確的是
A.以Z濃度變化表示的反應速率為0.005mol/(Ls)
B.若增大壓強,則物質(zhì)Y的轉(zhuǎn)化率減小
C.當c(X):c(Y):c(Z)=2:1:1時,表明反應處于平衡狀態(tài)
D.若保持恒溫恒壓條件下再通入1molX和1molY進行反應,則平衡時X的轉(zhuǎn)化率將不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量的氨基甲酸置于恒容的密閉真空容器中(固體體積忽略不計),使其達到化學平衡:H2NCOONH4(s)![]() 2NH3(g)+CO2(g)。實驗測得不同溫度下的平衡數(shù)據(jù)列于下表
2NH3(g)+CO2(g)。實驗測得不同溫度下的平衡數(shù)據(jù)列于下表
溫度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡總壓強/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡氣體總濃度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
下列有關敘述正確的是
A. 在低溫下該反應能自發(fā)進行
B. 15℃時,該反應的化學平衡常數(shù)約為2.0
C. 當混合氣體平均相對分子質(zhì)量不變時,該反應達到化學反應限度
D. 恒溫條件下,向原平衡體系中再充入2molNH3和1molCO2,達平衡后CO2濃度不變
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com