
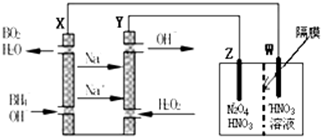
分析 (1)平衡常數K350℃<K300℃,說明溫度升高時平衡逆向移動,△H-T△S<0時,反應能夠自發進行;
(2)A、擴大容器體積,平衡逆向移動,但各組分濃度都減小;
B、恒溫恒容下,再充入2molNO2和1molO2,相當于加壓,平衡正向移動;
C、容器體積不變,氣體質量不變;
D、正反應放熱,降溫平衡正向移動;
(3)①部分電離的電解質是弱電解質,如果亞硝酸部分電離則亞硝酸是弱電解質,可以根據酸溶液或鈉鹽溶液的pH判斷;
②常溫下甲酸銨的水溶液pH<7,說明甲酸根離子的水解程度小于銨根離子的水解程度;
③甲酸銨中含有醛基,能夠被銀氨溶液氧化;
(4)根據鈉離子移動方向,判斷加入過氧化氫的一極為原電池的正極,發生還原反應,通入BH4-的一極為原電池的負極,發生氧化反應.
解答 解:(1)溫度升高時平衡逆向移動,說明正反應放熱;該反應的正反應放熱,則逆反應吸熱,△H>0,若逆反應能夠自發進行,則其,△H-T△S<0,必須要△S>0,故答案為:放熱;逆反應方向的△S>0;
(2)A、擴大容器體積,無論平衡怎樣移動,各組分濃度都減小,混合氣體顏色變淺,故A錯誤;
B、與開始加入比例相同加入反應物,平衡正向移動,反應物轉化率增大,故B正確;
C、容器中氣體密度始終不變,所以密度不變不能說明反應達到平衡狀態,故C錯誤;
D、降溫平衡正向移動,化學平衡常數增大,故D正確;
故答案為:BD;
(3)①A、亞硝酸鈉溶液的pH>7,說明亞硝酸鈉是強堿弱酸鹽,其溶液呈堿性,所以能證明亞硝酸是弱酸,故A正確;
B、亞硝酸能與氫氧化鈉發生中和反應只能說明亞硝酸具有酸性,不能說明亞硝酸的電離程度,所以不能證明亞硝酸是弱酸,故B錯誤;
C、用亞硝酸鈉溶液作導電實驗,燈泡很暗,不能說明亞硝酸的電離程度,所以不能證明亞硝酸是弱酸,故C錯誤;
D、常溫下,將pH=3的亞硝酸溶液稀釋10倍,pH<4,說明稀釋亞硝酸時,其氫離子物質的量增大,存在電離平衡,故D正確;
故答案為:AD;
②常溫下甲酸銨的水溶液pH<7,說明甲酸根離子的水解程度小于銨根離子的水解程度,離子濃度由大到小的順序為c(HCOO-)>c(NH4+)>c(H+)>c (OH-),
故答案為:c(HCOO-)>c(NH4+)>c(H+)>c (OH-);
③甲酸銨中含有醛基,能夠被銀氨溶液氧化,反應的化學方程式為HCOONH4+2[Ag(NH3)2]OH$\stackrel{水浴加熱}{→}$(NH4)2CO3+2Ag↓+3NH3+H2O,
故答案為:HCOONH4+2[Ag(NH3)2]OH$\stackrel{水浴加熱}{→}$(NH4)2CO3+2Ag↓+3NH3+H2O;
(4)根據鈉離子移動方向,判斷加入過氧化氫的一極為原電池的正極,發生還原反應,通入BH4-的一極為原電池的負極,發生氧化反應,電極反應式為:BH4-+8OH--8e-=BO2-+6H2O,故答案為:BH4-+8OH--8e-=BO2-+6H2O.
點評 本題考查了反應自發進行的條件、化學平衡的移動、鹽類水解以及離子濃度大小比較,考查范圍廣,難度較大.


 新黃岡兵法密卷系列答案
新黃岡兵法密卷系列答案科目:高中化學 來源: 題型:解答題
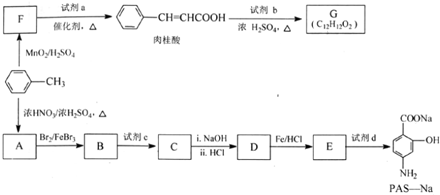
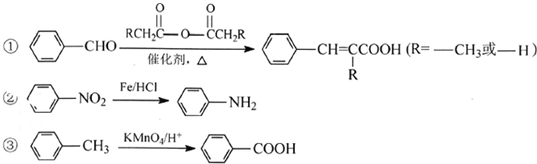
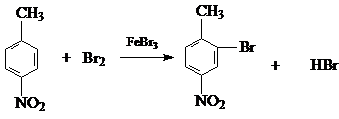 .
.  .
. 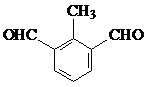 、
、 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用濃鹽酸與二氧化錳共熱制氯氣 | |
| B. | 標準狀況下,將1 g鋁片投入20 mL 18 mol•L-1硫酸中 | |
| C. | 向100 mL 4 mol•L-1硝酸中加入5.6 g 鐵 | |
| D. | 在5×107 Pa、500℃和鐵觸媒催化的條件下,用氮氣和氫氣合成氨 |
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河北石家莊辛集中學高二上階段考一化學卷(解析版) 題型:選擇題
分子式為C4H8Cl2的同分異構體有( )
A.3種 B.5種 C.8種 D.9種
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氨、硫、氯及其化合物對環境有著重要的影響,在化工生產和日常生活中的用途也十分廣泛,如用做漂白劑、沉淀劑、農藥、化肥等.
氨、硫、氯及其化合物對環境有著重要的影響,在化工生產和日常生活中的用途也十分廣泛,如用做漂白劑、沉淀劑、農藥、化肥等.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 將1.00mol•L-1 NaOH溶液滴入20.00mL 1.00mol•L-1的一元酸HA溶液中,測得混合溶液的pH和溫度隨加入NaOH溶液體積變化曲線如圖所示.下列說法正確的是( )
將1.00mol•L-1 NaOH溶液滴入20.00mL 1.00mol•L-1的一元酸HA溶液中,測得混合溶液的pH和溫度隨加入NaOH溶液體積變化曲線如圖所示.下列說法正確的是( )| A. | 室溫時,HA的電離度約為10-6 | |
| B. | 圖中B點時,溶液的KW略大于1×10-14 | |
| C. | 圖中C點時,溶液中c(A-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 圖中D點后,溶液溫度略下降的主要原因是生成的 NaA水解吸熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 澄清石灰水鑒別二氧化碳和二氧化硫 | |
| B. | 用KSCN溶液鑒別FeCl2和Fe2(SO4)3 | |
| C. | 用冷卻熱飽和溶液的方法鑒別NaCl溶液和KNO3溶液 | |
| D. | 用燃著的木條鑒別N2,H2和O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氟是電負性最大的非金屬元素,又因其半徑較小,極易和金屬元素反應,并將它們氧化到最高價態,生成MnF7、VF5、CaF2等.氟還可以和氧形成一系列的氟化物,如OF2、O2F2、O4F2等.請回答下列問題:
氟是電負性最大的非金屬元素,又因其半徑較小,極易和金屬元素反應,并將它們氧化到最高價態,生成MnF7、VF5、CaF2等.氟還可以和氧形成一系列的氟化物,如OF2、O2F2、O4F2等.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com