

分析 高嶺土用濃硫酸溶解,Al2O3、Fe2O3反應得到Al2(SO4)3、Fe2(SO4)3,SiO2不與硫酸反應,過濾得到濾渣1為SiO2,濾液中含有Al2(SO4)3、Fe2(SO4)3及剩余的硫酸,
研究發現,隨著酸熔溫度升高,氧化鋁的溶出率增大,但若酸熔時溫度過高(超過240℃),SiO2不僅會消耗硫酸,導致氧化鋁溶出率下降,還會同時產生高溫的腐蝕性氣體為三氧化硫,該副反應的化學方程式為SiO2+H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$H2SiO3+SO3↑;
向濾液中加入物質除去Fe元素,然后過濾,則濾渣2為氫氧化鐵,將濾液蒸發濃縮、冷卻結晶和過濾得到硫酸鋁晶體,用硫酸調節酸鋁比(溶液中游離硫酸和硫酸鋁的物質的量之比),再用氨水中和至一定的pH值即可析出銨明礬晶體,反應方程式為Al2(SO4)3+H2SO4+2NH3•H2O+22H2O=2[NH4Al(SO4)2•12H2O]↓
或Al2(SO4)3+H2SO4+2NH3+24H2O=2[NH4Al(SO4)2•12H2O]↓,結合題目分析解答.
解答 解:高嶺土用濃硫酸溶解,Al2O3、Fe2O3反應得到Al2(SO4)3、Fe2(SO4)3,SiO2不與硫酸反應,過濾得到濾渣1為SiO2,濾液中含有Al2(SO4)3、Fe2(SO4)3及剩余的硫酸,
研究發現,隨著酸熔溫度升高,氧化鋁的溶出率增大,但若酸熔時溫度過高(超過240℃),SiO2不僅會消耗硫酸,導致氧化鋁溶出率下降,還會同時產生高溫的腐蝕性氣體為三氧化硫,該副反應的化學方程式為SiO2+H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$H2SiO3+SO3↑;
向濾液中加入物質除去Fe元素,然后過濾,則濾渣2為氫氧化鐵,將濾液蒸發濃縮、冷卻結晶和過濾得到硫酸鋁晶體,用硫酸調節酸鋁比(溶液中游離硫酸和硫酸鋁的物質的量之比),再用氨水中和至一定的pH值即可析出銨明礬晶體,反應方程式為Al2(SO4)3+H2SO4+2NH3•H2O+22H2O=2[NH4Al(SO4)2•12H2O]↓
或Al2(SO4)3+H2SO4+2NH3+24H2O=2[NH4Al(SO4)2•12H2O]↓,
(1)高嶺土首先需要灼燒,實驗室灼燒高嶺土所需的實驗儀器有盛放藥品的儀器坩堝、泥三角、用于加熱的儀器酒精燈、盛放泥三角的儀器三腳架,
故選bdef;
(2)通過以上分析知,二氧化硅和濃硫酸反應方程式為SiO2+H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$H2SiO3+SO3↑,
故答案為:SiO2+H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$H2SiO3+SO3↑;
(3)鐵離子能和KSCN溶液反應生成血紅色溶液,所以要檢驗除鐵后的濾液中是否含有Fe3+,應采取的實驗方法為取少量除鐵后的濾液于試管中,滴加幾滴KSCN溶液,若溶液變為血紅色則含Fe3+,否則不含Fe3+;濾渣2的主要成分為Fe(OH)3,
故答案為:取少量除鐵后的濾液于試管中,滴加幾滴KSCN溶液,若溶液變為血紅色則含Fe3+,否則不含Fe3+;Fe(OH)3;
(4)“分離1”操作包含的實驗步驟有蒸發濃縮、冷卻結晶、過濾、洗滌、干燥,
故答案為:蒸發濃縮;冷卻結晶;過濾;
(5)通過以上分析知,該過程中的總反應方程式Al2(SO4)3+H2SO4+2NH3•H2O+22H2O=2[NH4Al(SO4)2•12H2O]↓或Al2(SO4)3+H2SO4+2NH3+24H2O=2[NH4Al(SO4)2•12H2O]↓,
故答案為:Al2(SO4)3+H2SO4+2NH3•H2O+22H2O=2[NH4Al(SO4)2•12H2O]↓或Al2(SO4)3+H2SO4+2NH3+24H2O=2[NH4Al(SO4)2•12H2O]↓.
點評 本題考查物質分離和提純,為高頻考點,側重考查學生分析能力、實驗基本操作能力等,明確流程圖中發生的反應及基本操作方法、物質性質是解本題關鍵,知道常見儀器用途,題目難度不大.


 點睛新教材全能解讀系列答案
點睛新教材全能解讀系列答案 小學教材完全解讀系列答案
小學教材完全解讀系列答案科目:高中化學 來源: 題型:解答題
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 3 | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.80g | B. | 0.02g | C. | 0.23g | D. | 0.46g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化合物:干冰、冰水共存物、燒堿、小蘇打 | |
| B. | 非電解質:乙醇、四氯化碳、氯氣、葡萄糖 | |
| C. | 同素異形體:活性炭、C60、石墨烯、金剛石 | |
| D. | 混合物:鋁熱劑、純凈礦泉水、分析純鹽酸、漂白粉 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
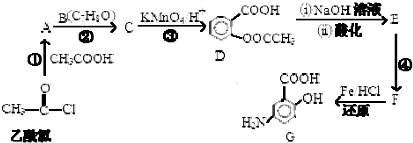
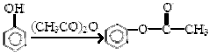 ,
, (具有還原性,極易被氧化)
(具有還原性,極易被氧化) .
. .
. (寫出其中一種結構簡式)
(寫出其中一種結構簡式)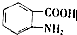 的流程圖(無機試劑任選).合成路線流程圖如下:X$→_{反應條件}^{反應物}$Y$→_{反應條件}^{反應物}$Z…目標產物.
的流程圖(無機試劑任選).合成路線流程圖如下:X$→_{反應條件}^{反應物}$Y$→_{反應條件}^{反應物}$Z…目標產物.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 有人設計出一種在隔絕空氣條件下讓鈉與FeSO4溶液反應的方法以驗證反應實質.實驗時,往100mL大試管中先加40mL煤油,取3粒米粒大小的金屬鈉放入大試管后塞上橡皮塞,通過長頸漏斗加入FeSO4溶液使煤油的液面至膠塞,并夾緊彈簧夾(如圖),仔細觀察,回答下列問題:
有人設計出一種在隔絕空氣條件下讓鈉與FeSO4溶液反應的方法以驗證反應實質.實驗時,往100mL大試管中先加40mL煤油,取3粒米粒大小的金屬鈉放入大試管后塞上橡皮塞,通過長頸漏斗加入FeSO4溶液使煤油的液面至膠塞,并夾緊彈簧夾(如圖),仔細觀察,回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com