
【題目】對于可逆反應mA(s)+nB(g)eC(g)+fD(g),反應過程中,當其它條件不變時C 的百分含量與溫度 (T)和壓強(P)關系如圖所示,下面敘述正確的是( )
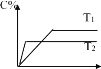
A.使用催化劑,C 的百分含量增大
B.升溫,化學平衡向正反應方向移動
C.化學方程式的化學計量數關系 n<e+f
D.其他條件不變,增入 A 物質,提高 B 的轉化率
【答案】C
【解析】
A. 使用催化劑,降低反應活化能,加快反應速率,平衡不移動,C 的百分含量不變,A錯誤;
B. 升高溫度,反應速率加快,由C 的百分含量與溫度 (T)的圖可知,T2>T1,且T2時的C 的百分含量小于T1時的C 的百分含量,所以升高溫度,化學平衡向逆反應方向移動,B錯誤;
C. 壓強增大,反應速率加快,由C 的百分含量與溫度 (P)的圖可知,P2>P1,且P2時的C 的百分含量小于P1時的C 的百分含量,所以壓強增大,化學平衡向逆反應方向移動,化學方程式的化學計量數關系 n<e+f,C正確;
D. 該反應中,A為固態,增入A物質,平衡不移動,B的轉化率不變,D錯誤;故答案為:C。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
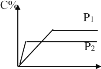
【題目】三元催化轉化器能同時凈化汽車尾氣中的碳氫化合物(HC)、一氧化碳(CO)及氮氧化合物(NOx)三種污染物。催化劑選擇鉑銠合金,合金負載量不同時或不同的工藝制備的合金對汽車尾氣處理的影響如圖所示。下列說法正確的是
A.圖甲表明,其他條件相同時,三種尾氣的轉化率隨合金負載量的增大而增大
B.圖乙表明,尾氣的起燃溫度隨合金負載量的增大而降低
C.圖甲和圖乙表明,合金負載量越大催化劑活性越高
D.圖丙和圖丁表明,工藝2制得的合金的催化性能優于工藝1制得的合金
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒容密閉容器中,進行如下反應:NO(g)+CO(g)![]()
![]() N2(g)+CO2(g);△H=﹣373.2kJ/mol達到平衡后,為提高NO的轉化率,采取的正確措施是( )
N2(g)+CO2(g);△H=﹣373.2kJ/mol達到平衡后,為提高NO的轉化率,采取的正確措施是( )
A. 加催化劑B. 充入CO增大壓強C. 充入N2D. 升高溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中,濃硫酸既表現出強氧化性又表現出酸性的是( )
A. 2NaCl+H2SO4(濃)![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
B. Na2SO3+H2SO4(濃)![]() Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
C. C+2H2SO4(濃)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
D. 2FeO+4H2SO4(濃)![]() Fe2(SO4)3+SO2↑+4H2O
Fe2(SO4)3+SO2↑+4H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒容密閉容器中通入一定量的X氣體與Y氣體并發生反應:2X(g)+Y(g)2Z(g),測得在溫度T1、T2下X的物質的量濃度c(x)隨時間t變化的曲線如圖所示,下列敘述正確的是
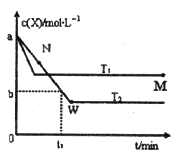
A.該反應進行到M點放出的熱量大于進行到W點放出的熱量
B.T2下,在0t1時間內,υ(Y)=![]()
C.M點的平衡常數比W點的平衡常數小
D.M點時再加入一定量的X,平衡后X的轉化率增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素周期表中大多數元素是金屬元素,金屬及其化合物在生活生產中有著重要應用,根據試題信息,完成下列計算:
(1)某常見二價金屬12.6g與足量稀硫酸反應,生成氫氣5.04L(S.T.P),該元素原子的摩爾質量為__g/mol.
(2)39.32g某金屬混合物,由12.32g鎂和0.25mol另一種比鎂不活潑的金屬元素A組成,該混合物與一定量鹽酸反應,產生氫氣4.928L(S.T.P),則參加反應的HCl為__mol,金屬A的相對原子質量為__.
(3)由NaCl、NaHCO3、Na2CO310H2O組成的混合物157.8g,充分加熱后,產生的氣體(氣體溫度150℃)依次通過無水CaCl2和堿石灰,兩種吸收劑分別增重59.4g和13.2g,則混合物中NaHCO3的質量分數為___,若等質量的該混合物與足量鹽酸反應,產生二氧化碳(S.T.P)__L.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】哈伯因發明了由氮氣和氫氣合成氨氣的方法而獲得1918年諾貝爾化學獎。現向一密閉容器中充入1mol N2和3mol H2,在一定條件下使該反應發生:N2+3H2![]() 2NH3。下列有關說法正確的是( )
2NH3。下列有關說法正確的是( )
A. 達到化學平衡時,正反應和逆反應的速率都為零
B. 當符合:3正N2=正H2時,反應達到平衡狀態
C. 達到化學平衡時,單位時間消耗a molN2,同時生成3a molH2
D. 當N2、H2、NH3的分子數比為1∶3∶2,反應達到平衡狀態
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用酸式滴定管準確移取 25.00mL 某未知濃度的鹽酸于一潔凈的錐形瓶中,然后用0.2000molL﹣1 的氫氧化鈉溶液滴定(指示劑為酚酞),滴定結果如下:
NaOH 起始讀數 | NaOH 終點讀數 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 19.30mL |
第三次 | 0.50mL | 16.30mL |
(1)根據以上數據可以計算出鹽酸的物質的量濃度為________molL﹣1。
(2)酸式滴定管使用的第一步操作是________
(3)以下操作造成測定結果偏高的原因可能是________。
A.振蕩錐形瓶時有液滴濺出
B.滴定終點讀數時,俯視滴定管的刻度,其它操作均正確
C.盛裝未知液的錐形瓶用蒸餾水洗過,未用待測液潤洗
D.滴定到終點讀數時發現滴定管尖嘴處懸掛一滴溶液
E.未用標準液潤洗堿式滴定管
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】舍勒發現氯氣是在1774年,當時他正在研究軟錳礦(二氧化錳),當他使軟錳礦與濃鹽酸混合并加熱時,產生了一種黃綠色的氣體,發生反應的方程式為MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O,這種氣體的強烈的刺激性氣味使舍勒感到極為難受,但是當他確信自己制得了一種新氣體后,他又感到一種由衷的快樂。舍勒制備出氯氣以后,把它溶解在水里,發現這種水溶液對紙張、蔬菜和花都具有永久性的漂白作用;他還發現氯氣能與金屬、非金屬、堿等發生化學反應。
MnCl2+Cl2↑+2H2O,這種氣體的強烈的刺激性氣味使舍勒感到極為難受,但是當他確信自己制得了一種新氣體后,他又感到一種由衷的快樂。舍勒制備出氯氣以后,把它溶解在水里,發現這種水溶液對紙張、蔬菜和花都具有永久性的漂白作用;他還發現氯氣能與金屬、非金屬、堿等發生化學反應。
舍勒發現氯氣是在1774年,當時他正在研究軟錳礦(二氧化錳),當他使軟錳礦與濃鹽酸混合并加熱時,產生了一種黃綠色的氣體,發生反應的方程式為MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O,這種氣體的強烈的刺激性氣味使舍勒感到極為難受,但是當他確信自己制得了一種新氣體后,他又感到一種由衷的快樂。舍勒制備出氯氣以后,把它溶解在水里,發現這種水溶液對紙張、蔬菜和花都具有永久性的漂白作用;他還發現氯氣能與金屬、非金屬、堿等發生化學反應。
MnCl2+Cl2↑+2H2O,這種氣體的強烈的刺激性氣味使舍勒感到極為難受,但是當他確信自己制得了一種新氣體后,他又感到一種由衷的快樂。舍勒制備出氯氣以后,把它溶解在水里,發現這種水溶液對紙張、蔬菜和花都具有永久性的漂白作用;他還發現氯氣能與金屬、非金屬、堿等發生化學反應。
(1)氯氣和氫氣的反應的屬于____________
A.分解反應 B.化合反應 C.置換反應 D.復分解反應
(2)對于反應MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O,下列說法正確的是_____________
MnCl2+Cl2↑+2H2O,下列說法正確的是_____________
A.MnO2是還原劑 B.MnCl2是氧化產物
C.Cl2是氧化產物 D.H2O是還原產物
(3)下列反應條件的改變對實驗室制備氯氣速率的影響正確的是_____________
A.增大鹽酸的濃度能加快反應速率
B.若用稀鹽酸與二氧化錳反應則反應速率較慢
C.升高溫度能減慢反應速率
D.增加MnO2的質量可顯著加快反應速率
(4)氫氣在氯氣中燃燒為放熱反應,下列說法正確的是________________
A.斷開Cl—Cl鍵放出能量 B.形成H—Cl鍵吸收能量
C.燃燒都是放熱反應 D.反應物的總能量小于生成物的總能量
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com