
 某課外興趣小組對H2O2的分解速率做了如下實驗探究.
某課外興趣小組對H2O2的分解速率做了如下實驗探究.| 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
| 無催化劑、不加熱 | 幾乎不反應 | 幾乎不反應 | 幾乎不反應 | 幾乎不反應 |
| 無催化劑、加熱 | 360 | 480 | 540 | 720 |
| MnO2催化劑、加熱 | 10 | 25 | 60 | 120 |
分析 (1)①過氧化氫溶液是實驗室制取氧氣的重要藥品,在常溫下很難分解得到氧氣,其分解速度受濃度、溫度、催化劑等因素的影響;
②設計實驗方案來證明時,要注意實驗的控制變量,以確保實驗結果的準確性;
(2)①二氧化錳是過氧化氫分解的催化劑,由帶火星木條復燃,可知產物,由此可寫出方程式;
②根據濃度對反應速率的影響分析;
③酸化的H2O2的與MnO2反應生成Mn2+和O2.
解答 解:(1)①根據表中給出的數據,無催化劑不加熱的情況下,不同濃度的過氧化氫溶液都是幾乎不反應,在無催化劑加熱的情況下,不同濃度的過氧化氫溶液都分解,說明過氧化氫的分解速率與溫度有關,但是得到相同氣體的時間不同,濃度越大,反應的速度越快,說明過氧化氫的分解速率與濃度有關;比較同一濃度的過氧化氫溶液如30%時,在無催化劑加熱的時候,需要時間是360s,有催化劑加熱的條件下,需要時間是10s,說明過氧化氫的分解速率與溫度、催化劑有關,故答案為:溫度;催化劑;
②分析表中數據可以看出,濃度越大,反應速率越快,加熱能加快過氧化氫的分解,有催化劑是分解速率快,
故答案為:溫度升高化學反應速率加快;反應物濃度增大化學反應速率加快;使用合適的催化劑化學反應速率加快;
(2)①H2O2在二氧化錳作用下發生反應的化學反應方程式為:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,故答案為:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;
②因在其他條件相同時,隨反應的進行,溶液濃度減小,即時反應速率逐漸減小,C的斜率也最小,故反應速率最慢,故答案為:C;
③酸化的H2O2的與MnO2反應生成Mn2+和O2,反應的方程式為:MnO2+2H++H2O2=Mn2++O2↑+2H2O.故答案為:MnO2+2H++H2O2=Mn2++O2↑+2H2O.
點評 本題通過圖表數據,考察了外界條件對反應速率的影響,難度適中,要注意分析其他條件相同,只有一個條件改變時,如何影響反應速率.


科目:高中化學 來源: 題型:解答題
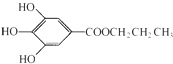 ,是白色粉末,難溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化劑.
,是白色粉末,難溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化劑.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
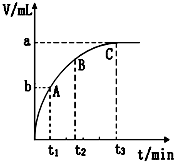
 某溫度時,在容積為3L的密閉容器中,X、Y、Z三種物質的物質的量隨時間變化的曲線如圖所示,由圖中數據分析:
某溫度時,在容積為3L的密閉容器中,X、Y、Z三種物質的物質的量隨時間變化的曲線如圖所示,由圖中數據分析:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗操作 | 實驗目的 | |
| A | 將鹵代烴加入到熱NaOH溶液中一段時間后,取上層液體,加入AgNO3液產生沉淀 | 證明鹵代烴中含有鹵元素 |
| B | 向丙烯醛(CH2=CH-CHO)中加入足量新制銀氨溶液后,滴入KMnO4(H+)溶液,觀察紫色褪去 | 證明結構中存在碳碳雙鍵 |
| C | 淀粉在硫酸催化作用下水解,將新制氫氧化銅懸濁液加入到水解后的溶液中 | 檢驗淀粉水解的產物葡萄糖 |
| D | 向純堿中滴加醋酸,將產生的氣體先通入飽和碳酸氫鈉溶液再通入苯酚鈉濃溶液 | 證明酸性:醋酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
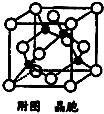
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
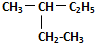 和
和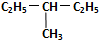 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
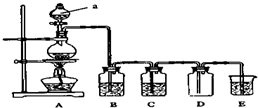 如圖是實驗室中制備氣體或驗證氣體性質的裝置圖.
如圖是實驗室中制備氣體或驗證氣體性質的裝置圖.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com