
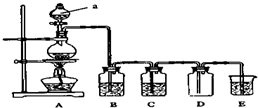
 如圖是實驗室中制備氣體或驗證氣體性質的裝置圖.
如圖是實驗室中制備氣體或驗證氣體性質的裝置圖.分析 (1)熟悉儀器圖形,說出其名稱;
(2)①二氧化錳與濃鹽酸在加熱條件下反應生成氯化錳、水和氯氣;
②濃鹽酸易揮發,制取的氯氣中含有氯化氫,氯化氫易溶于水氯氣在水中溶解度較小,可以用飽和食鹽水除去氯化氫;
氯氣有毒,直接排放引起空氣污染,氯氣能夠與氫氧化鈉反應生成氯化鈉、次氯酸鈉和水,可用氫氧化鈉溶液吸收氯氣;
(3)先驗證二氧化硫后驗證二氧化碳,二氧化硫具有漂白性,要先在B裝置中放入品紅溶液驗證二氧化硫;由于二氧化硫也能與石灰水反應產生沉淀會干擾二氧化碳的驗證,所以在驗證二氧化碳之前要保證把二氧化硫除去,這樣就需要在C裝置中放入酸性高錳酸鉀溶液,D中裝入品紅溶液,檢驗二氧化硫是否除盡,最后用澄清石灰水檢驗二氧化碳的存在.
解答 解:(1)儀器a的名稱是分液漏斗;
故答案為:分液漏斗;
(2)①二氧化錳與濃鹽酸在加熱條件下反應生成氯化錳、水和氯氣,離子方程式:MnO2+4H++2Cl-═Mn2++Cl2+2H2O;
故答案為:MnO2+4H++2Cl-═Mn2++Cl2+2H2O;
②濃鹽酸易揮發,制取的氯氣中含有氯化氫,氯化氫易溶于水氯氣在水中溶解度較小,可以用飽和食鹽水除去氯化氫;氯氣有毒,直接排放引起空氣污染,氯氣能夠與氫氧化鈉反應生成氯化鈉、次氯酸鈉和水,可用氫氧化鈉溶液吸收氯氣;
故答案為:飽和NaCl溶液;吸收氯氣防污染;
(3)先驗證二氧化硫后驗證二氧化碳,二氧化硫具有漂白性,要先在B裝置中放入品紅溶液驗證二氧化硫;由于二氧化硫也能與石灰水反應產生沉淀會干擾二氧化碳的驗證,所以在驗證二氧化碳之前要保證把二氧化硫除去,這樣就需要在C裝置中放入酸性高錳酸鉀溶液,D中裝入品紅溶液,檢驗二氧化硫是否除盡,最后用澄清石灰水檢驗二氧化碳的存在;
①二氧化硫具有漂泊性,能夠使品紅溶液褪色,據此檢驗二氧化硫的存在;
故答案為:B;品紅溶液褪色;
②證明SO2具有還原性裝置為C,現象酸性高錳酸鉀褪色;
故答案為:C中KMnO4溶液褪色;
③為排除二氧化硫對二氧化碳檢驗的干擾,應在D中加入品紅溶液,檢驗SO2是否除盡;
故答案為:檢驗SO2是否除盡;
④如果D中品紅不褪色,說明二氧化硫除盡,則能夠使澄清石灰水變渾濁的其他
D中品紅不褪色且E中石灰水變渾濁的氣體為二氧化碳;
故答案為:D中品紅不褪色且E中石灰水變渾濁.
點評 本題考查了氯氣的制備,二氧化硫、二氧化碳的檢驗,熟悉裝置的特點及各物質的性質是解題關鍵,題目難度中等.


 字詞句段篇系列答案
字詞句段篇系列答案科目:高中化學 來源: 題型:解答題
 某課外興趣小組對H2O2的分解速率做了如下實驗探究.
某課外興趣小組對H2O2的分解速率做了如下實驗探究.| 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
| 無催化劑、不加熱 | 幾乎不反應 | 幾乎不反應 | 幾乎不反應 | 幾乎不反應 |
| 無催化劑、加熱 | 360 | 480 | 540 | 720 |
| MnO2催化劑、加熱 | 10 | 25 | 60 | 120 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
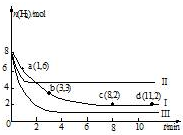 一定溫度下,向容積為2L的恒容密閉容器中充入6molCO2和8molH2,發生反應:
一定溫度下,向容積為2L的恒容密閉容器中充入6molCO2和8molH2,發生反應:| A. | 該反應在0~8min內CO2的平均反應速率是0.375mol•L-1•min-1 | |
| B. | 若起始時向上述容器中充入3molCO2和4molH2,則平衡時H2的條件分數大于20% | |
| C. | 若起始是向上述容器中充入4molCO2、2molH2、2molCH3OH和1molH2O(g),則此是反應向正反應方向進行 | |
| D. | 改變條件得到曲線II、III,則曲線II、III改變的他分別是升高溫度、充入氫氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 工業制金屬鈉:電解飽和食鹽水 | |
| B. | 工業制溴:某些植物有富集溴的能力,從海產品中提取溴是工業上獲取溴的重要途徑 | |
| C. | 冶煉鋁:電解Al2O3,同時加入冰晶石(Na3AlF6),目的是為了降低Al2O3熔融溫度 | |
| D. | 硫酸工業:在氧氣充足的情況下,從接觸室進入吸收塔的氣體中不可能含有SO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 已知:A是石油裂解氣的主要成份,A的產量通常用來衡量一個國 家的石油化工水平.現以A為主要原料合成乙酸乙酯,其合成路線如圖所示.
已知:A是石油裂解氣的主要成份,A的產量通常用來衡量一個國 家的石油化工水平.現以A為主要原料合成乙酸乙酯,其合成路線如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
NaHCO3溶液 BaCl2濃度 | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | 渾濁 | 渾濁 | 少許渾濁 |
| 0.1mol•L-1 | 渾濁 | 少許渾濁 | 無現象 |
| 0.02mol•L-1 | 少許渾濁 | 無現象 | 無現象 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 6.72L CO | B. | 6.6g CO2 | C. | 8 g SO2 | D. | 9.6g H2SO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 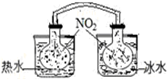 依據兩容器內氣體顏色變化,判斷反應2NO2(g)?N2O4(g)平衡移動的方向 | |
| B. | 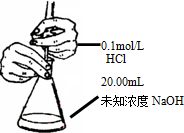 測定錐形瓶內的NaOH的濃度 | |
| C. | 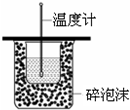 測定中和熱 | |
| D. | 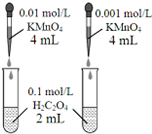 依據褪色快慢比較濃度對反應速率的影響 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


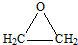 .
.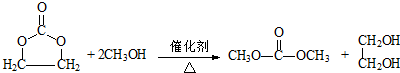 .
.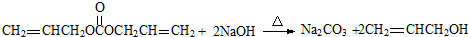 .
. .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com