
分析 結構決定性質.分析乙醛分子的結構特點:含有C=O,能發生加成反應;含有醛基,能發生氧化反應,據此提出猜想可能發生加成反應或者是發生氧化反應;
根據取代反應的原理,如果發生取代反應則取代生成n(HBr)=n(Br-)=amol;根據加成反應的原理,如果發生加成反應則n(Br-)=0mol;如果發生的是氧化反應,則Br2被還原得到的溴離子物質的量n(Br-)=2amol;
根據題意知固體1.88g為AgBr的質量,n(AgBr)=$\frac{1.88g}{188g/mol}$=0.01mol,所以n(Br-)=0.01mol,n(Br-)=2n(Br2),由于溴水將乙醛氧化為乙酸的同時,產生的Br-的物質的量是Br2的物質的量的2倍,所以反應應為氧化反應,發生氧化還原反應的方程式為:CH3CHO+Br2+H2O=CH3COOH+2HBr;
乙醛如果發生取代生成HBr,發生氧化反應生成CH3COOH和HBr,都能使反應后溶液顯酸性,故方案一不可行.
解答 解:【提出猜想】
乙醛分子中有C=O不飽和鍵,可能與溴水發生加成反應使溴水褪色;乙醛中含有醛基,具有還原性,可能與溴水發生氧化還原反應使溴水褪色,
故答案為:②由于乙醛分子中含有不飽和鍵,溴水可能與乙醛發生加成反應;
③由于乙醛含有醛基,具有還原性,溴水可能將乙醛氧化為乙酸;
【解釋與結論】
如果發生取代反應則取代生成n(HBr)=n(Br-)=amol;如果發生加成反應則n(Br-)=0mol;如果發生的是氧化反應,則Br2被還原得到的溴離子物質的量n(Br-)=2amol,已知CH3COOAg易溶解于水,所以固體1.88g為AgBr的質量,n(AgBr)=$\frac{1.88g}{188g/mol}$=0.01mol,n(AgBr )=n(Br-)=0.01mol,n(Br2)=0.005mol,所以n(Br-)=2n(Br2),由于溴水將乙醛氧化為乙酸的同時,產生的Br-的物質的量是Br2的物質的量的2倍,所以反應應為氧化反應;
故答案為:加成; 取代;氧化;氧化反應;根據n(Br-)=2n(Br2),由于溴水將乙醛氧化為乙酸的同時,產生的Br-的物質的量是Br2的物質的量的2倍,所以反應應為氧化反應;CH3CHO+Br2+H2O=CH3COOH+2HBr;
[反思與評價]
方案一中,乙醛發生取代生成HBr,還是發生氧化反應生成CH3COOH和HBr,都能使反應后溶液顯酸性,故方案一不可行.
故答案為:不可行;不管乙醛發生取代生成HBr,還是發生氧化反應生成CH3COOH和HBr,都能使反應后溶液顯酸性.
點評 本題考查乙醛化學性質的探究,題目難度中等,本題注意把握各類有機反應的機理,為解答該題的關鍵.


科目:高中化學 來源: 題型:解答題
| 物質 | 熔點/℃ | 沸點/℃ | 化學性質 |
| S | 112.8 | 444.6 | 略 |
| S2Cl2 | -77 | 137 | 遇水生成HCl、SO2、S 3000C以上完全分解 |

| 實驗步驟 | 實驗現象和結論 |
| 1.取少量溶液于試管中,滴入幾滴KMnO4溶液 | KMnO4溶液顏色由紫色變綠色,說明溶液中大量存在SO32- |
| 2.另取少量溶液于試管中,加入2-3滴酚酞溶液 | 溶液顏色由無色變紅,說明溶液中大量存在OH- |
| 3.另取少量溶液于試管中,加入足量1mol•L-1HNO3,再加入少量AgNO3溶液 | 仍有白色沉淀產生,說明溶液中大量存 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 I.已知H2(g)、CO(g)和CH3OH(l)的標準燃燒熱△H分別為-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.則甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式為CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
I.已知H2(g)、CO(g)和CH3OH(l)的標準燃燒熱△H分別為-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.則甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式為CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
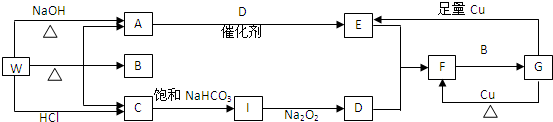
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 滴定次數 | 待測溶液的體積/mL | 標準溶液的體積 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 1.00 | 21.00 |
| 3 | 25.00 | 1.20 | 21.21 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
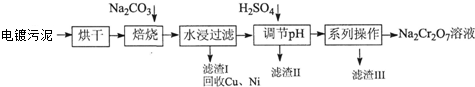
| 20℃ | 60℃ | 100℃ | |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7[來源:] | 183 | 269 | 415 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分散質粒子直徑在10-9~l0-7m之間 | B. | 是一種純凈物 | ||
| C. | 具有丁達爾效應 | D. | 具有凈水作用 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖是一個用鉑絲作電極,電解Na2SO4溶液的裝置,電解液中加有酚酞.閉合開關,電解一段時間后發現:a、b試管中產生氣體的體積比為2:1.
如圖是一個用鉑絲作電極,電解Na2SO4溶液的裝置,電解液中加有酚酞.閉合開關,電解一段時間后發現:a、b試管中產生氣體的體積比為2:1.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com