
分析 (1)根據蓋斯定律,①×2+②可得目標反應,據此計算出△H4;
(2)可逆反應達到平衡狀態時,正逆反應速率相等,各組分的濃度、百分含量不再變化,據此進行判斷;
(3)根據化學平衡常數的概念及該反應方程式寫出其表達式;
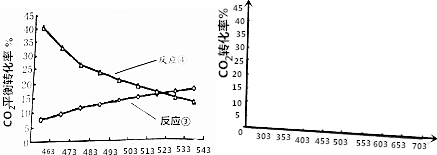
(4)①根據圖象可知,升高溫度,二氧化碳的轉化率增大,則平衡向著正向移動,據此判斷焓變;
②根據反應③為吸熱反應、反應④為放熱反應分析;
③反應④在503K時達到平衡,則在該溫度下二氧化碳的轉化率最高,據此畫出圖象.
解答 解:(1)反應①CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H1=-49.01kJ/moL
反應②2CH3OH(g)?CH3OCH3(g)+H2O(l)△H2=-24.52kJ/moL,
根據蓋斯定律,①×2+②可得:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)△H4=(-49.01kJ/moL)×2+(-24.52kJ/moL)=-122.54kJ/mol,
故答案為:-122.54kJ/mol;
(2)反應③CO2(g)+H2(g)?CO(g)+H2O(l),
A.v正(H2)=v逆(H2O),正逆反應速率相等,達到了平衡狀態,故A正確;
B.n(CO2):n(H2):n(CO):n(H2O)=1:1:1:1,不能證明各組分的濃度不再變化,無法判斷是否達到平衡狀態,故B錯誤;
C.由于反應前后氣體質量不相等,在恒容條件下,反應過程中混合氣體的密度始終發生變化,所以混合氣體的密度不變,證明各組分濃度不再變化,已經達到平衡狀態,故C正確;
D.反應前后氣體混合氣體的平均相對分子質量不變,表面各組分濃度不變,該反應已經達到平衡狀態,故D正確;
E.該反應是氣體體積縮小的反應,若容器的壓強不變,說明正逆反應速率相等,已經達到平衡狀態,故E正確;
故答案為:B;
(3)2CH3OH(g)?CH3OCH3(g)+H2O的平衡常數表達式為:K=$\frac{c({H}_{2}O)•c(C{H}_{3}OC{H}_{3})}{c({C{H}_{3}OH)}^{2}}$,
故答案為:K=$\frac{c({H}_{2}O)•c(C{H}_{3}OC{H}_{3})}{c({C{H}_{3}OH)}^{2}}$;
(4)①根據圖象可知,升高溫度后反應二氧化碳的轉化率增大,說明升高溫度平衡向著正向移動,則正反應為吸熱反應,所以△H3>0,
故答案為:>;
②由于反應③為吸熱反應,反應④為放熱反應,所以在較低溫度下,反應③的平衡轉化率較小而反應④較大,故低溫對反應④有利,二甲醚的產率較高,
故答案為:低溫;較低溫度下,反應③的平衡轉化率較小而反應④較大,所以低溫對反應④有利,二甲醚的產率較高;
③反應④在503K時達到平衡,則從298K開始,二氧化碳的轉化率逐漸增大,當溫度達到503K時,二氧化碳的轉化率達到最大,當溫度大于503K后,二氧化碳的轉化率會減小,則CO2轉化率隨溫度升高的變化曲線為: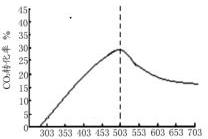 ,
,
故答案為: .
.
點評 本題考查較為綜合,涉及蓋斯定律的應用、化學平衡狀態的判斷、化學圖象的分析等知識,題目難度中等,明確化學平衡及其影響為解答關鍵,注意掌握蓋斯定律的內容及其應用方法,試題培養了學生的分析能力及靈活應用能力.


 快樂暑假暑假能力自測中西書局系列答案
快樂暑假暑假能力自測中西書局系列答案科目:高中化學 來源: 題型:選擇題
| A. | b-a=n+m | B. | a-b=n-m | C. | 質子數Y>X | D. | 核電荷數Y<X |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用鉑金做首飾不能用金屬鍵理論解釋 | |
| B. | 固態和熔融時易導電,熔點在1 000℃左右的晶體可能是金屬晶體 | |
| C. | Li、Na、K的熔點逐漸升高 | |
| D. | 金屬導電和熔融電解質(或電解質溶液)導電的原理一樣 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只有④ | B. | ①②④ | C. | ①②③ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 工業上常利用油脂的堿性水解制取肥皂 | |
| B. | 霧、雞蛋清水溶液、水與乙醇的混合液均具有丁達爾效應 | |
| C. | 蔬菜汁餅干易氧化變質:建議包裝餅干時,加入一小包鐵粉作抗氧化劑和吸水劑并密封 | |
| D. | 浸泡過高錳酸鉀溶液的硅藻士可以吸收乙烯,所以可用此物保鮮水果 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
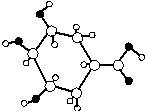
| A. | 該有機物不含苯環 | |
| B. | 分子式為C7H12O4 | |
| C. | 能與NaHCO3溶液反應生成CO2 | |
| D. | 1mol該有機物與足量的金屬鈉反應產生2molH2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用帶橡皮塞的棕色細口瓶盛放濃硝酸 | |
| B. | 滴定管經蒸餾水潤洗后,即可注入標準液進行滴定 | |
| C. | 用干燥清潔的玻璃棒蘸取某溶液點在pH試紙中部,跟標準比色卡比較來測定該溶液的pH | |
| D. | 配制溶液時加水超過容量瓶的標線,用滴管把多余的液體吸出 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com