
分析 (1)升溫甲醇的生成率減小,說明升溫平衡那些移動;
(2)增大反應速率的因素有升溫、加壓、增大反應物或生成物濃度等等,據此分析;
(3)提高CO轉化率應使平衡正向移動.
解答 解:(1)升溫平衡那些移動,說明正反應放熱,故答案為:放熱;
(2)a、移走甲醇,降低生成物濃度,反應速率減慢,故a選;
b、增大壓強,反應速率加快,故b不選;
c、擴大容器體積,反應物和生成物濃度降低,反應速率減慢,故c選;
d、升溫反應速率加快,故d不選;
故答案為:ac;
(3)該反應為正反應氣體體積減小的放熱反應,加壓或增大氫氣濃度能加快反應速率,又能使一氧化碳的轉化率提高,故答案為:增大壓強;增加氫氣的濃度.
點評 本題考查了影響平衡移動和化學反應速率的因素,題目難度不大.


科目:高中化學 來源: 題型:多選題
| A. | CH3Br | B. | CH3CH2CH2CH2Br | ||
| C. | CH2BrCH2Br | D. | CH2BrCH2CH2CH2Br |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用反應物A表示該反應的反應速率為0.6 mol•L-1•min-1 | |
| B. | 用反應物B表示該反應的反應速率為2.4 mol•L-1•min-1 | |
| C. | 2v(B)=3v(C) | |
| D. | 用生成物C表示該反應的反應速率為3.6 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | S | B. | NH3 | C. | Fe | D. | Na |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在0.1mol/LNaHCO3溶液中:c(Na+)>c(HCO3-)>C(CO32-)>c(H2CO3) | |
| B. | 在0.1mol/LNa2CO3溶液中:c(OH-)-c(H+)=c(HC03-)+c(H2CO3) | |
| C. | 向0.2mol/LNaHCO3溶液中加入等體積0.1mol/LNaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常溫下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol/L]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| MnO2 | 觸摸試管情況 | 觀察結果 | 反應完成所需的時間 |
| 粉末狀 | 很燙 | 劇烈反應,帶火星的木條復燃 | 3.5min |
| 塊狀 | 微熱 | 反應較慢,火星紅亮但木條未復燃 | 30min |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 已知A為金屬單質,根據下列變化完成以下問題:
已知A為金屬單質,根據下列變化完成以下問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
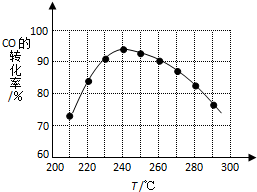 二甲醚(CH3OCH3)在未來可能替代柴油和液化氣作為潔凈液體燃料使用.工業上以CO和H2為原料生產CH3OCH3的新工藝主要發生三個反應:
二甲醚(CH3OCH3)在未來可能替代柴油和液化氣作為潔凈液體燃料使用.工業上以CO和H2為原料生產CH3OCH3的新工藝主要發生三個反應:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com