
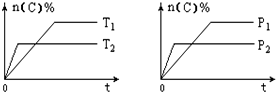
 可逆反應aA(g)+bB(s)?cC(g)+dD(g),其他條件不變,C的物質的量分數和溫度(T)或壓強(P)關系如圖,其中正確的是( )
可逆反應aA(g)+bB(s)?cC(g)+dD(g),其他條件不變,C的物質的量分數和溫度(T)或壓強(P)關系如圖,其中正確的是( )| A. | 使用催化劑,C的物質的量分數增加 | |
| B. | 升高溫度,平衡向正反應方向移動 | |
| C. | 化學方程式的系數a<c+d | |
| D. | 根據圖象無法確定改變溫度后平衡移動方向 |
分析 催化劑改變反應速率不改變化學平衡,可逆反應,當其他條件一定時,溫度越高,反應速率越大,達到平衡所用的時間越短.由圖象(1)可知T2>T1,溫度越高,平衡時C的體積分數φ(C)越小,故此反應的正反應為放熱反應;當其他條件一定時,壓強越高,反應速率越大,達到平衡所用的時間越短.由圖(2)可知p2>p1,壓強越大,平衡時C的體積分數φ(C)越小,可知正反應為氣體物質的量增大的反應,即a<c+d,據此結合外界條件對化學平衡的影響分析解答.
解答 解:可逆反應,當其他條件一定時,溫度越高,反應速率越大,達到平衡所用的時間越短.由圖象(1)可知T2>T1,溫度越高,平衡時C的體積分數φ(C)越小,故此反應的正反應為放熱反應;當其他條件一定時,壓強越高,反應速率越大,達到平衡所用的時間越短.由圖(2)可知p2>p1,壓強越大,平衡時C的體積分數φ(C)越小,可知正反應為氣體物質的量增大的反應,即a<c+d;
A、催化劑只改變化學反應速率,對平衡移動沒有影響,C的質量分數不變,故A錯誤;
B、正反應為放熱反應,升溫平衡逆向移動,故B錯誤;
C、壓強越大,平衡時C的體積分數φ(C)越小,可知正反應為氣體物質的量增大的反應,即a<c+d,故C正確;
D、T2>T1,溫度越高,平衡時C的體積分數φ(C)越小,故此反應的正反應為放熱反應,升溫平衡逆向移動,可以判斷,故D錯誤;
故選C.
點評 本題考查化學平衡圖象問題,題目難度中等,注意根據圖象判斷外界條件對平衡的移動的影響是解答該題的關鍵.


科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

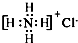
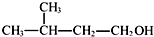
| A. | ①②③ | B. | ③④ | C. | ②④⑤ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 新制的氯水保存在無色玻璃瓶中 | |
| B. | 氫氣在氯氣中燃燒生成白色煙霧 | |
| C. | 常溫下,濃硝酸可用鋁罐來貯存,說明濃硝酸具有強氧化性 | |
| D. | 向蔗糖中加入濃硫酸后出現發黑現象,說明濃H2SO4具有吸水性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
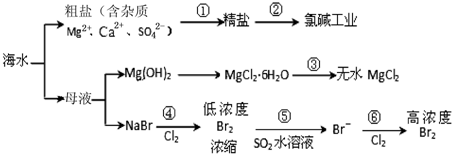
| A. | 除去粗鹽中雜質(Mg2+、Ca2+、SO42-),加入的藥品順序為:NaOH溶液→Na2CO3溶液→BaCl2溶液→過濾后加鹽酸 | |
| B. | 在過程③中將MgCl2•6H2O灼燒即可制得無水MgCl2 | |
| C. | 在過程④、⑥反應中每氧化0.2 mol Br- 需消耗2.24 L Cl2 | |
| D. | 從第④步到第⑥步的目的是為了濃縮富集溴 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗操作 | 實驗數據或現象 | 結論 | |
| A | 用PH計分別測定SO2和CO2飽和溶液的PH | 前者PH小 | H2SO3酸性強于H2CO3 |
| B | 向Ag Cl懸濁液中加入NaI溶液 | 產生黃色沉淀 | Ksp(AgI)>Ksp(AgCl) |
| C | 向滴用酚酞的氨水中加入少量CH3COONH4固體 | 溶液紅色變淺 | 氨水中存在電離平衡 |
| D | 等體積、等PH的HA和HB兩種酸溶液分別與足量的鋅反應 | 相同時間內,HA酸產生的氫氣多 | HA是強酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 元素在周期表中的位置,反映了元素的原子結構和元素的性質.如圖是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子結構和元素的性質.如圖是元素周期表的一部分.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com