
 元素在周期表中的位置,反映了元素的原子結構和元素的性質.如圖是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子結構和元素的性質.如圖是元素周期表的一部分.分析 (1)N元素處于周期表中第二周期ⅤA族;同主族自上而下非金屬性減弱,非金屬性越強,最高價氧化物對應水化物的酸性越強;
(2)最高正化合價=族序數,最低負化合價=族序數-8;
(3)元素的非金屬性越小,單質的氧化性越弱,與H2反應限度越小.
解答 解:(1)N元素原子有2個電子層,最外層電子數為5,位于元素周期表中第二周期第ⅤA族;同主族從上到下非金屬性減弱,則最高價含氧酸的酸性越弱,則酸性H3AsO4<H3PO4,
故答案為:第二周期第ⅤA族;<;
(2)S元素處于ⅥA族,硫元素的最高正價=族序數=+6,最低負價=族序數-8=6-8=-2,
故答案為:+6;-2;
(3)非金屬性Se<S,元素的非金屬性越小,單質的氧化性越弱,與H2反應限度越小;
故答案為:更小.
點評 本題考查元素周期表與元素周期律,側重于考查學生綜合運用化學知識的能力,注意相關基礎知識的積累.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化學 來源: 題型:選擇題
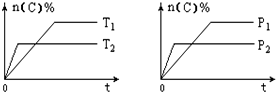 可逆反應aA(g)+bB(s)?cC(g)+dD(g),其他條件不變,C的物質的量分數和溫度(T)或壓強(P)關系如圖,其中正確的是( )
可逆反應aA(g)+bB(s)?cC(g)+dD(g),其他條件不變,C的物質的量分數和溫度(T)或壓強(P)關系如圖,其中正確的是( )| A. | 使用催化劑,C的物質的量分數增加 | |
| B. | 升高溫度,平衡向正反應方向移動 | |
| C. | 化學方程式的系數a<c+d | |
| D. | 根據圖象無法確定改變溫度后平衡移動方向 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應熱就是反應中放出的能 | |
| B. | 在101 kPa時,1 mol碳燃燒所放出的熱量為碳的燃燒熱 | |
| C. | 由C(s,石墨)=C(s,金剛石),△H=1.9 kJ•mol-1可知,金剛石比石墨穩定 | |
| D. | 等量的硫蒸氣和硫固體分別完全燃燒,前者放出的熱量多 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{16n}{3m-2n}$ | B. | $\frac{32n}{n-m}$ | C. | $\frac{32m}{3n-2m}$ | D. | $\frac{32n}{3n-2m}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可能有甲烷 | B. | 一定有乙烯 | C. | 可能有丙炔 | D. | 一定無C4H4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 元素編號 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半徑/mn | 0.037 | 0.074 | 0.082 | 0.099 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合價或最低化合價 | +1 | -2 | +3 | -1 | -2 | +3 | +1 | +1 |
| A. | 元素④氣態氫化物的穩定性大于元素⑤氣態氫化物的穩定性 | |
| B. | 元素②氣態氫化物的沸點小于元素⑤氣態氫化物的沸點 | |
| C. | 元素②⑥形成的化合物具有兩性 | |
| D. | 元素④的最高價氧化物的水化物比元素⑤的最高價氧化物的水化物酸性強 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ④⑤⑥ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度/℃ | 25 | T2 |
| 水的離子積常數 | 1×10-14 | 1×10-12 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com