
| 選項 | 氯氣通入下列溶液中 | 實驗現象 | 結論 |
| A | 滴有KSCN的FeCl2溶液 | 變紅 | 氯氣具有還原性 |
| B | 滴有酚酞的NaOH溶液 | 褪色 | 氯氣具有漂白性 |
| C | 紫色石蕊溶液 | 先變紅后褪色 | 氯氣具有酸性、漂白性 |
| D | 少量氯氣通入大量水中 | 溶液pH<7 呈淺黃綠色 | 氯氣與水反應生成酸性物質, 且該反應為可逆反應 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯氣具有氧化性,氧化氯化亞鐵為氯化鐵;
B.氯氣通入滴有酚酞的氫氧化鈉溶液,和氫氧化鈉反應,溶液褪色;
C.氯氣通入紫色石蕊試液,氯氣和水反應生成鹽酸和次氯酸,溶液先變紅色后褪色;
D.氯氣通入水中反應生成鹽酸和次氯酸,溶液顯酸性,氯氣和水的反應是化學平衡為可逆反應.
解答 解:A.氯氣具有氧化性,氯氣通入滴有KSCN的FeCl2溶液,氧化氯化亞鐵為氯化鐵,發生反應2FeCl2+Cl2=2FeCl3,溶液變紅色是發生了反應Fe3++3SCN-=Fe(SCN)3,故A錯誤;
B.氯氣通入滴有酚酞的氫氧化鈉溶液,和氫氧化鈉反應,溶液褪色,Cl2+2NaOH=NaCl+NaClO+H2O,氯氣布具有漂白性,故B錯誤;
C.氯氣通入紫色石蕊試液,氯氣和水反應生成鹽酸和次氯酸,鹽酸的酸性使溶液呈紅色,次氯酸具有漂白性使溶液褪色,現象為溶液先變紅色后褪色,故C錯誤;
D.氯氣通入水中反應生成鹽酸和次氯酸,溶液顯酸性,Cl2+H2O?HCl+HClO,氯氣和水的反應是化學平衡為可逆反應,故D正確;
故選D.
點評 本題考查了氯氣性質,主要是氯氣氧化性、次氯酸的漂白性的應用,注意溶液顏色變化的判斷,題目較簡單.


科目:高中化學 來源: 題型:選擇題
 用下列裝置(尾氣處理已略去)進行相關實驗,能實現實驗目的是( )
用下列裝置(尾氣處理已略去)進行相關實驗,能實現實驗目的是( )| 實驗目的 | a中試劑 | b中試劑 | c中試劑 | |
| A | 比較H2CO3、H2SiO3 的酸性 | 醋酸溶液 | 碳酸鈉 | 硅酸鈉溶液 |
| B | 比較Cl2、I2的 氧化性 | 濃鹽酸 | 高錳酸鉀 | 碘化鉀溶液 |
| C | 制備NaHCO3 | 鹽酸 | 大理石 | 飽和碳酸鈉溶液 |
| D | 證明C2H2有還原性 | 飽和食鹽水 | 電石 | 酸性高錳酸鉀溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學反應必然伴隨能量的變化 | |
| B. | 我國目前使用的主要能源是化石能源 | |
| C. | 需要加熱才能發生的反應一定是吸熱反應 | |
| D. | 化學反應一定有化學鍵的斷裂與形成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
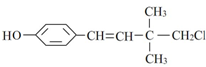 ,下列說法不正確的是( )
,下列說法不正確的是( )| A. | 有順反異構 | |
| B. | 可以和濃溴水發生取代反應和加成反應 | |
| C. | 可以發生加聚反應、水解反應和消去反應 | |
| D. | 1mol該化合物最多能與4 mol H2發生加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol 18O含有的中子數為10NA | |
| B. | 22.4L甲烷氣體中所含分子數目為NA | |
| C. | 1L 0.1mol•L-1NH4Cl 溶液中NH4+數目為 0.1NA | |
| D. | 1L pH=1的醋酸溶液中,CH3COOH分子的數目為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯分子的電子式:Cl:Cl | B. | 水分子的電子式: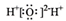 | ||
| C. | 氯離子的結構示意圖: | D. | 質量數為37的氯原子:${\;}_{37}{\;}^{17}Cl$ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 配制FeSO4溶液時,加入一些鐵粉 | |
| B. | 500℃左右比室溫更有利于合成氨的反應 | |
| C. | 實驗室常用排飽和食鹽水的方法收集氯氣 | |
| D. | 由H2、I2(g)、HI組成的平衡體系,加壓后顏色加深 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=4.3的CH3COOH與CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | 濃度為0.2mol/L的CH3COOH溶液和農地為0.1mol/L的NaOH溶液等體積混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] | |
| C. | 醋酸溶液加少量水稀釋,$\frac{c(C{H}_{3}COOH)}{{c}^{2}({H}^{+})}$幾乎不變 | |
| D. | amol/LCH3COOH溶液與bmol/LNaOH溶液等體積混合,所得溶液中c(Na+)>c(CH3COO-),則一定有a≤b |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com