


分析 根據題中工業流程,重晶石礦(主要成分BaSO4,雜質為Fe2O3、SiO2)與碳在焙燒的條件下得BaS、Fe,SiO2不反應,用鹽酸酸溶后,BaS與鹽酸反應得硫化氫和氯化鋇,鐵與鹽酸反應生成氫氣和氯化亞鐵,SiO2不溶,不溶物A應為SiO2,由于流程最后要得到氯化鋇晶體,所以沉淀反應中加入的試劑R可以為氧化鋇或氫氧化鋇等,沉淀物B應為氫氧化鐵,經過蒸發濃縮、降溫結晶、過濾、洗滌、干燥等操作可得氯化鋇晶體,
(1)根據流程分析A的成分,焙燒得到氣體為一氧化碳;
(2)根據配制一定物質的量濃度溶液的操作可以確定所需要的儀器;
(3)試劑R的作用是將鐵離子沉淀掉,且不引入新的雜質;沉淀反應主要是將鐵離子沉淀完全;
(4)將BaCl2•nH2O充分加熱失去結晶水,根據加熱前后固體物質的質量可以確定n值;根據實驗對恒重的要求答題;空氣中有水份,對實驗有影響;
(5)重晶石礦與碳以及氯化鈣共同焙燒,可以直接得到氯化鋇,由于硫化鈣不溶于水,所以將焙燒得的固體直接溶于水,過濾除去固體雜質,可以得到氯化鋇溶液,為了溶解充分可以用熱水,濾液經過蒸發濃縮、降溫結晶、過濾、洗滌、干燥可得氯化鋇晶體;
解答 解:根據題中工業流程,重晶石礦(主要成分BaSO4,雜質為Fe2O3、SiO2)與碳在焙燒的條件下得BaS、Fe,SiO2不反應,用鹽酸酸溶后,BaS與鹽酸反應得硫化氫和氯化鋇,鐵與鹽酸反應生成氫氣和氯化亞鐵,SiO2不溶,不溶物A應為SiO2,由于流程最后要得到氯化鋇晶體,所以沉淀反應中加入的試劑R可以為氧化鋇或氫氧化鋇等,沉淀物B應為氫氧化鐵,經過蒸發濃縮、降溫結晶、過濾、洗滌、干燥等操作可得氯化鋇晶體,
(1)根據流程分析A的成分為C和SiO2,焙燒得到氣體為一氧化碳,可以用點燃的方法進行處理,故選c,
故答案為:SiO2;c;
(2)根據配制一定物質的量濃度溶液的操作可知所需要的玻璃儀器為玻璃棒、燒杯、500mL容量瓶、膠頭滴管,
故答案為:燒杯、500mL容量瓶、膠頭滴管;
(3)試劑R的作用是將鐵離子沉淀掉,且不引入新的雜質,試劑R可以為氧化鋇,證明沉淀已經完全的方法是取上層清液于小試管中,滴入氫氧化鈉溶液,若無沉淀產生,說明沉淀完全,
故選b;取上層清液于小試管中,滴入氫氧化鈉溶液,若無沉淀產生,說明沉淀完全;
(4)將BaCl2•nH2O充分加熱失去結晶水,根據加熱前后固體物質的質量可以確定n值,所以實驗步驟為①稱量樣品 ②加熱 ③置于干燥器中冷卻 ④稱量 ⑤恒重操作,恒重操作是指再進行加熱、冷卻、稱量,直到連續兩次稱量的結果相差不超過0.001g為止,第③步物品之所以放在干燥器中冷卻的原因是防止冷卻過程中吸收空氣中的水分,造成實驗誤差,
故答案為:加熱;干燥器;再進行加熱、冷卻、稱量,直到連續兩次稱量的結果相差不超過0.001g為止;防止冷卻過程中吸收空氣中的水分,造成實驗誤差;
(5)重晶石礦與碳以及氯化鈣共同焙燒,可以直接得到氯化鋇,由于硫化鈣不溶于水,所以將焙燒得的固體直接溶于水,過濾除去固體雜質,可以得到氯化鋇溶液,為了溶解充分可以用熱水,濾液經過蒸發濃縮、降溫結晶、過濾、洗滌、干燥可得氯化鋇晶體,
故答案為:熱水浸取;蒸發濃縮;冷卻結晶;過濾.
點評 本題考查學生在“工藝流程閱讀、相關反應化學方程式書寫、化學反應條件控制的原理、生產流程的作用”等方面對元素化合物性質及其轉化關系的理解和應用程度,考查學生對新信息的處理能力,題目難度中等.


 名師點睛字詞句段篇系列答案
名師點睛字詞句段篇系列答案科目:高中化學 來源: 題型:選擇題
| A. | CH3COOH+CH3CH2OH$→_{加熱}^{濃硫酸}$CH3COOCH2CH33+H2O | |
| B. | 2CH3CH2OH+O2 $→_{△}^{催化劑}$ 2CH3CHO+2H2O | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| D. | 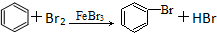 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 離子符號 | Fe3+ | Fe2+ | Cu2+ |
| 氫氧化物開始沉淀時的pH | 2.5 | 7.0 | 4.7 |
| 氫氧化物完全沉淀時的pH | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙醇(水) 加新制的生石灰,過濾 | |
| B. | 乙烷(乙烯) 通過溴的四氯化碳溶液,洗氣 | |
| C. | 溴(苯) 加水,振蕩,靜置后分液 | |
| D. | 乙酸乙酯(乙酸) 加飽和Na2CO3溶液,振蕩,靜置后分液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com