
| A. | 鐵粉有剩余,溶液呈淺綠色,Cl-基本保持不變 | |
| B. | 往溶液中滴入無色KSCN溶液,溶液變紅色 | |
| C. | Fe2+和Fe3+物質的量之比為5:1 | |
| D. | 氧化產物和還原產物的物質的量之比為2:5 |
分析 鐵粉的物質的量為$\frac{11.2g}{56g/mol}$=0.2mol,氯化鐵的物質的量為2mol/L×0.25L=0.5mol,鐵粉與氯化鐵的離子反應方程式為:Fe+2Fe3+=3Fe2+,根據反應的物質的量之比等于計量數之比知,0.2mol鐵粉完全反應需要0.4mol氯化鐵,氯化鐵有剩余,結合方程式計算解答.
解答 解:鐵粉的物質的量為$\frac{11.2g}{56g/mol}$=0.2mol,氯化鐵的物質的量為2mol/L×0.25L=0.5mol,鐵粉與氯化鐵的離子反應方程式為:Fe+2Fe3+=3Fe2+,假設0.2mol鐵粉完全反應,則消耗氯化鐵為0.2mol×2=0.4mol<0.5mol,氯化鐵有剩余.
A.鐵完全反應,氯化鐵有剩余,Cl-濃度基本不變,故A錯誤;
B.氯化鐵有剩余,往溶液中滴入無色KSCN溶液,溶液顯紅色,故B正確;
C.0.2molFe反應生成Fe2+為0.6mol,剩余Fe3+為0.5mol-0.4mol=0.1mol,其物質的量之比為6:1,故C錯誤;
D.氧化產物與還原產物均為氯化亞鐵,Fe被氧化,氯化鐵被還原,則氧化產物與還原產物的物質的量之比為1:2,故D錯誤,
故選B.
點評 本題考查化學方程式有關計算,難度不大,關鍵是根據化學方程式的進行過量計算.


科目:高中化學 來源: 題型:選擇題
| A. | 離子化合物中一定含有金屬元素 | |
| B. | 金屬元素不可能存在于陰離子中 | |
| C. | 含有非極性鍵的化合物不一定是共價化合物 | |
| D. | 由兩種元素構成的共價化合物分子中的化學鍵都是極性鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C23H48、C25H52、C27H56互為同系物 | |
| B. | 1molC23H48含共價鍵70mol | |
| C. | C23H48、C25H52、C27H56的碳含量依次減小 | |
| D. | C23H48、C25H52、C27H56均能發生取代反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2、O2分別為0.8 mol/L、0.4mol/L | B. | SO2為0.5mol/L | ||
| C. | SO2、SO3均為0.3mol/L | D. | SO2為0.5mol/L,SO3為0.2 mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 三氟化氮的電子式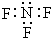 | B. | 水合氫離子電子式: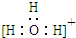 | ||
| C. | 氟離子的結構示意圖: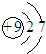 | D. | 中子數為18的硫原子${\;}_{16}^{34}$S |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 熱化學方程式中的化學計量數表示物質的量,可以是分數 | |
| B. | △H>0表示放熱,△H<0表示吸熱 | |
| C. | 0.5mol H2SO4與0.5molBa(OH)2反應生成1mol水時放出的熱叫做中和熱 | |
| D. | 1molH2與0.5molO2燃燒放出的熱就是H2的燃燒熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蒸干碳酸鉀溶液得到的固體物質為KOH | |
| B. | 鐵表面鍍銅時,銅與電源的負極相連,而鐵與電源的正極相連 | |
| C. | 工業合成氨反應溫度選擇700 K左右,可使催化劑活性最強并提高原料利用率 | |
| D. | CO(g)的燃燒熱是283.0kJ/mol,則2CO2(g)=2CO(g)+O2(g)反應的△H=2×283.0kJ/mol |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com