
| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | i | |||||||||||||
| j | |||||||||||||||||
| 鋰 | X | Y | |
| 失去第一個電子 | 519 | 502 | 580 |
| 失去第二個電子 | 7296 | 4570 | 1820 |
| 失去第三個電子 | 11799 | 6920 | 2750 |
| 失去第四個電子 | 9550 | 11600 |
分析 由元素在周期表中的位置可知,a為H、b為He、c為N、d為O、e為Na、f為Mg、g為Al、h為Si、i為Cl、j為Co.
(1)j為Co,原子核外有27個電子,根據(jù)構造原理書寫;
(2)同周期原子半徑從左向右減小;N原子的最外層p電子半滿,為穩(wěn)定結構,第一電離能高于同周期相鄰越大;同周期自左而右電負性增大;
(3)j為Co,處于第四周期第Ⅷ族;氨水電離生成NH4+、OH-,說明NH3•H2O 中O-H鍵發(fā)生斷裂;
(4)由表中數(shù)據(jù)可知,X的第二電離能劇增,故X表現(xiàn)+1價,處于第ⅠA族,且第一電離能比Li的小,說明比鋰的金屬性強,應為上述元素中的Na元素;由表中數(shù)據(jù)可知,Y的第四電離能劇增,故Y表現(xiàn)+3價,最外層電子數(shù)為3,應為ⅢA族元素,應為上述元素中的Al;
(5)元素的特征電子排布式為nsnnpn+1,s軌道最多有2個電子,所以n=2,即電子排布式為1s22s22p3,該元素為N元素,與元素①形成的分子X為NH3,為三角錐型.
解答 解:由元素在周期表中的位置可知,a為H、b為He、c為N、d為O、e為Na、f為Mg、g為Al、h為Si、i為Cl、j為Co.
(1)j是鈷元素,原子序數(shù)為27,其電子排布式為[Ar]3d74s2,外圍電子排布式為3d74s2,
故答案為:3d74s2;
(2)c為N,d為O,同周期原子半徑從左向右減小,則原子半徑為c>d,N原子的最外層p電子半滿,為穩(wěn)定結構,則第一電離能為c>d,同周期自左而右電負性增大,電負性越大,則電負性為c<d,
故答案為:>;>;<;
(3)j為Co,處于第四周期第Ⅷ族;
NH3溶于水后,形成的NH3•H2O中,NH3•H2O的電離方程式為NH3•H2O
故答案為:四、Ⅷ;b;
(4)由表中數(shù)據(jù)可知,X的第二電離能劇增,故X表現(xiàn)+1價,處于第ⅠA族,且第一電離能比Li的小,說明比鋰的金屬性強,應為上述元素中的Na元素;由表中數(shù)據(jù)可知,Y的第四電離能劇增,故Y表現(xiàn)+3價,最外層電子數(shù)為3,應為ⅢA族元素,應為上述元素中的Al,
故答案為:Na;Al;
(5)元素的特征電子排布式為nsnnpn+1,s軌道最多有2個電子,所以n=2,即電子排布式為1s22s22p3,該元素為N元素,最外層為第2層,2s電子為孤對電子,孤對電子數(shù)為1,與元素①形成的分子X為NH3,N原子為sp3雜化,含有1對共用電子對,其空間構型為三角錐形,故答案為:1;三角錐形.
點評 本題是對物質結構的考查,涉及元素周期表、核外電子排布、半徑比較、電離能、電負性、氫鍵、分子結構等,側重對主干知識的考查,需要學生具備扎實的基礎,難度中等,注意理解同周期中第一電離能異常的原因.


科目:高中化學 來源: 題型:選擇題
| 溫度/℃ | n(活性炭)/mol | n(CO2)/mol |
| T1 | 0.70 | |
| T2 | 0.25 |
| A. | 上述信息可推知:T1<T2 | |
| B. | T1℃時,該反應的平衡常數(shù)K=$\frac{9}{16}$ | |
| C. | T1℃時,若開始時反應物的用量均減小一半,平衡后NO的轉化率減小 | |
| D. | T2℃時,若反應達平衡后再縮小容器的體積,c(N2):c(NO)不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
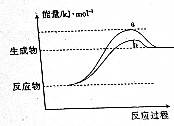 在598K的條件下進行人工固氮反應:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),該反應過程中能量變化的曲線如圖所示.請回答下列問題:
在598K的條件下進行人工固氮反應:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),該反應過程中能量變化的曲線如圖所示.請回答下列問題:| 溫度/K | N2的轉化率 |
| 598 | a1 |
| 898 | a2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
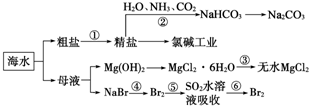
| A. | 過程①中除去粗鹽中的SO${\;}_{4}^{2-}$、Ca2+、Mg2+、Fe3+等雜質,加入的藥品順序為:Na2CO3溶液→NaOH溶液→BaCl2溶液→過濾后加鹽酸 | |
| B. | 過程②中應先通入NH3再通入CO2氣體 | |
| C. | 過程③中結晶出的MgCl2•6H2O要在HCl氛圍中加熱脫水制得無水MgCl2 | |
| D. | 從第⑤~⑥步的目的是濃縮、富集溴單質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某溶液中滴入稀鹽酸,生成無色氣體,說明原溶液中有一定有CO32- | |
| B. | 加入碳酸鈉溶液產生白色沉淀,再加鹽酸,白色沉淀消失,一定有Ba2+ | |
| C. | 加入硝酸銀溶液有白色沉淀產生,則一定有Cl- | |
| D. | 分別含有Mg2+、Cu2+和Na+的三種鹽酸鹽溶液,用NaOH溶液就能一次鑒別開 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com