
| 草酸鈧絡鹽 | 溫度區間(K) | 質量(g) |
| Sc2(C2O4)3•6H2O | 298 | 0.462 |
| 383~423 | 0.372 | |
| 463~508 | 0.354 | |
| 583~873 | 0.138 |
分析 (1)根據鈧的原子序數及基態原子核外電子排布式判斷其未成對電子數,再判斷與鈧同周期且含有相同未成對電子數的非金屬元素;
(2)離子晶體熔沸點高低取決于離子鍵的強弱,離子鍵強弱與陰陽離子半徑和大小有關;
(3)氯化鈉和氯化鉀晶體都屬于離子晶體,二者的陰離子相同,而鈉離子半徑小于鉀離子,則氯化鈉的晶格能大于氯化鉀;
(4)水分子的中心原子O形成了兩個O-H鍵,還存在2對孤對電子,則雜化方式為sp3雜化;
(5)根據表中數據計算出各溫度段發生質量變化的原因,從而得出Sc2(C2O4)3•6H2O中的水分子種類;
(6)Sc2(C2O4)3•6H2O從583K加熱到873K,斷裂的化學鍵由草酸根離子與鈧離子之間的離子鍵及草酸根離子中的共價鍵.
解答 解:(1)鈧為21號元素,基態原子核外電子排布式為:1s2 2s2 2p6 3s2 3p6 3d1 4s2,位于第四周期ⅢB族,其未成對電子數為1,在第四周期中,未成對電子數為1的非金屬元素為Br,
故答案為:Br;
(2)根據圖1可知,鈧的電離能Ⅰ1、Ⅰ2、Ⅰ3變化較小,而到Ⅰ4時變化較大,所以$\frac{{I}_{2}}{{I}_{1}}$的比值小于$\frac{{I}_{4}}{{I}_{3}}$,
故答案為:<;
(3)鈉離子與鉀離子帶電荷相同,鈉離子半徑小與鉀離子半徑,作用力大,離子鍵強,所以熔點要更高,
故答案為:鈉離子半徑小于鉀離子,氯化鈉晶格能大于氯化鉀,所以氯化鈉熔點高;
(4)H2O分子中的中心原子O原子形成了2個氧氫鍵,還存在兩個孤電子對,所以O原子采用sp3雜化,即:H2O分子中O原子提供sp3雜化軌道形成H-O σ鍵
故答案為:sp3雜化;
(5)0.462g Sc2(C2O4)3•6H2O的物質的量為:$\frac{0.462g}{462g/mol}$=0.001mol,383~423K時失去水的物質的量為:$\frac{0.462g-0.372g}{18g/mol}$=0.005mol,失去水的數目為:$\frac{0.005mol}{0.001}$=5;463~508K時失去水的物質的量為:$\frac{0.372g-0.354g}{18g/mol}$=0.001mol,失去水的數目為:$\frac{0.001mol}{0.001mol}$=1,此時 Sc2(C2O4)3•6H2O中的水完全失去,最后生成的物質為0.1molSc2O3,質量為:138g/mol×0.001mol=0.138g,與題中數據吻合,所以Sc2(C2O4)3•6H2O中的水分子可以分為2種,
故答案為:2;
(6)根據(5)的計算可知,Sc2(C2O4)3•6H2O從583K加熱到873K,斷裂的化學鍵有:草酸根離子與鈧離子之間的離子鍵及草酸根離子中的共價鍵,
故答案為:離子鍵、共價鍵.
點評 本題考查了位置、結構與性質關系的應用,題目難度中等,涉及元素周期律與周期表的應用、化學鍵類型及雜化方式等知識,注意熟練掌握原子結構與元素周期律、元素周期律的關系,試題知識點較多、綜合性較強,充分考查了學生靈活應用基礎知識的能力.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
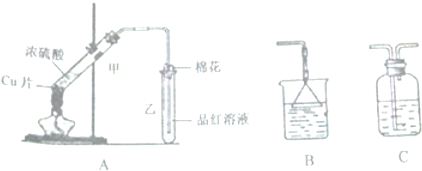
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
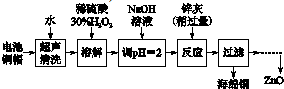
| 開始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 9 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 柴油、汽油、牛油、植物油等屬于烴類物質 | |
| B. | 含五個碳原子的有機物,分子中最多可形成四個碳碳單鍵 | |
| C. |  是某有機物與H2發生加成反應后的產物.符合該條件的穩定有機物共有3種 是某有機物與H2發生加成反應后的產物.符合該條件的穩定有機物共有3種 | |
| D. | 結構片段為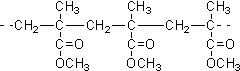 的高聚物,是其單體通過縮聚反應生成 的高聚物,是其單體通過縮聚反應生成 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
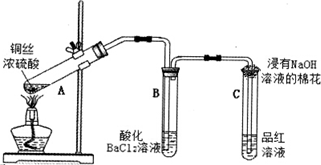
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 該氨水顯弱堿性 | |
| B. | 加水稀釋過程中,c(H+)/c(OH-)的值減小 | |
| C. | 與同溫下pH=11的NaOH溶液相比,NaOH溶液中c(Na+)大于氨水中c(NH4+) | |
| D. | 加入少量NH4Cl 固體,溶液中水的電離平衡:H2O?H++OH-向右移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 離子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 濃度(mol/L) | 3×10-6 | 7×10-6 | 2×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com