
 (1)在兩個恒溫、恒容的密閉容器中進行下列兩個可逆反應:
(1)在兩個恒溫、恒容的密閉容器中進行下列兩個可逆反應:分析 (1)甲反應是氣體體積減小的反應,乙是氣體體積不變的反應,判斷反應達到平衡狀態的標志是正逆反應速率相同,各組分含量保持不變,及其衍生的物理量分析判斷;注意乙反應是一個反應前后氣體體積不變的化學反應,所以不能用壓強判斷平衡;
(2)根據化學反應中各物質的物質的量變化量,圖象變化分析根據v=$\frac{△c}{△t}$計算化學反應速率;根據平衡圖象計算物質的量濃度及轉化率.
解答 解:(1)①混合氣體密度不變,甲反應是氣體體積減小的反應,甲容器中氣體體積不變,質量會變,密度也變,能判斷達到平衡,由于乙反應的兩邊氣體的體積相同且都是氣體,容器的容積不變,所以密度始終不變,無法判斷乙是否達到平衡狀態;
②反應容器中生成物的百分含量不變是平衡標志;
③反應物的消耗速率與生成物的消耗速率之比等于系數之比,說明正逆反應速率相同,反應甲、乙達到平衡狀態;
④恒溫時,氣體壓強不再改變,乙反應的兩邊氣體的體積相同且都是氣體,壓強始終不變,所以壓強不變無法判斷乙是否達到平衡狀態,可以判斷甲達到平衡狀態;
⑤甲反應是氣體體積減小的反應,乙是氣體體積不變的反應,混合氣體的總物質的量不變說明甲達到平衡狀態,乙不能判斷是否達到平衡狀態;
故答案為:①②③④⑤;②③;
(2)反應開始到10s,用Z表示的反應速率為:v=$\frac{△c}{△t}$=$\frac{\frac{1.58mol}{2L}}{10s}$=0.079mol/(L•s),
反應開始到10s,X的物質的量濃度減少的量為:△c=$\frac{1.20mol-0.41mol}{2L}$=0.395mol/L,反應開始到10s時,Y的轉化率為$\frac{1.0mol-0.21mol}{1.0mol}$×100%=79%,
故答案為:0.079mol/(L•s);0.395mol/L;79%.
點評 本題考查了化學平衡狀態的判斷,物質的量隨時間的變化曲線,以及化學平衡的計算,難度不大,注意反應前后氣體體積不變的化學反應不能用壓強來判斷是否達到平衡狀態.


科目:高中化學 來源: 題型:選擇題
| A. | 該反應屬于置換反應 | B. | 該反應的還原劑是NH3 | ||
| C. | Cl2的氧化性小于N2 | D. | 被氧化的NH3占參加反應NH3的1/4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+Fe3+ Cl-NO3- (1:1:3:1) | |
| B. | Ca2+ K+ OH- HCO3- (1:1:2:1) | |
| C. | H+ SO42- OH- Ba2+ (2:1:2:1) | |
| D. | Na+ PO43- H+ SO42- (2:1:3:1) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 過氧化鈉的電子式: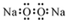 | B. | 中子數為 20 的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | 硫離子的結構示意圖: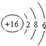 | D. | HCN的結構式:H-C≡N |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金剛石>晶體硅>二氧化硅>碳化硅 | B. | CI4>CBr4>CCl4>CH4 | ||
| C. | MgO>Na2O>N2>O2 | D. | 金剛石>生鐵>純鐵>鈉 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗編號 | 實驗步驟 | 實驗現象 |
| ② | 加入AgNO3溶液 | 有沉淀產生 |
| ③ | 加入足量NaOH溶液后加熱 | 收集氣體0.896L(標準狀況) |
| ④ | 加入足量的BaCl2 溶液 | 得到沉淀6.27g,沉淀經足量鹽酸洗滌、干燥后,剩余2.33g |
| A. | c(K+)≥0.2 mol/L | |
| B. | 一定存在的離子:Cl-、NH4+、CO32-、SO42- | |
| C. | 一定不存在的離子:Ca2+、K+、Cl- | |
| D. | c(K+)+c(NH4+)=c(CO32-)+c(SO42-) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com