
分析 (1)酸或堿抑制水電離,含有弱離子的鹽促進水電離,酸中氫離子濃度越大或堿中氫氧根離子濃度越大,其抑制水電離程度越大;
(2)化學式中銨根離子個數相等的強電解質中,醋酸根離子促進銨根離子水解,氫離子抑制銨根離子水解,一水合氨是弱電解質,其電離程度較小;
(3)④NH4Cl和⑧NH3•H2O混合溶液,
A、如果溶液顯酸性,結合溶液中電荷守恒分析判斷:
B、如果c(C1-)=c(NH4+),依據溶液中電荷守恒分析判斷;
C、依據溶液中電荷守恒分析判斷其濃度大小;
D、若兩種溶液等體積混合所得溶液滿足混合溶液中的物料守恒;
E、所得溶液肯定滿足電荷守恒;
(4)水的電離是吸熱反應,升高溫度促進水電離;在t℃時將pH=11的溶液③a L與pH=1的溶液①b L混合(忽略混合后溶液體積的變化),若所得混合溶液的pH=2,溶液顯酸性,結合混合后溶液氫離子濃度列式計算;
(5)室溫下,測得溶液⑤CH3COONH4 的pH=7,說明溶液呈中性,醋酸根離子水解顯堿性,銨根離子水解顯酸性,二者程度相同.
解答 解:(1)酸或堿抑制水電離,含有弱離子的鹽促進水電離,酸中氫離子濃度越大或堿中氫氧根離子濃度越大,其抑制水電離程度越大,等濃度的這幾種溶液中,NH4Cl促進水電離,H2SO4中氫離子濃度是0.2mol/L、醋酸中氫離子濃度小于0.1mol/L、NaOH中氫氧根離子濃度為0.1mol/L,所以①.②.③.④四種溶液中由水電離出的H+濃度由大到小的順序是④>②>③>①,
故答案為:④>②>③>①;
(2)化學式中銨根離子個數相等的強電解質中,醋酸根離子促進銨根離子水解,氫離子抑制銨根離子水解,一水合氨是弱電解質,其電離程度較小,所以等濃度的這幾種溶液中,銨根離子濃度大小順序是)⑥>⑦>④>⑤>⑧,
故答案為:⑥>⑦>④>⑤>⑧;
(3)A、如果溶液顯酸性,c(C1-)+c(OH-)=c(NH4+)+c(H+),則c(C1-)>c(NH4+)>c(H+)>c(OH-),故A正確;
B、如果c(C1-)=c(NH4+),電荷守恒依據c(C1-)+c(OH-)=c(NH4+)+c(H+),c(H+)=c(OH-),則溶液顯中性,故B正確;
C、電荷守恒依據c(C1-)+c(OH-)=c(NH4+)+c(H+),c(C1-)>c(NH4+),c(OH-)<c(H+),其濃度大小不可能為:c(C1-)>c(NH4+)>c(OH-)>c(H+),故C錯誤;
D、若兩種溶液等體積混合所得溶液滿足關系:c(NH4+)+c(NH3•H2O)=2c(Cl-)=)0.1mol•L-1,故D錯誤;
E、所得溶液電荷守恒依據c(C1-)+c(OH-)=c(NH4+)+c(H+),肯定滿足關系:c(C1-)+c(OH-)=c(NH4+)+c(H+),故E正確,
故答案為:A B E;
(4)水的電離是吸熱反應,升高溫度促進水電離,則水的離子積常數增大,t℃時,Kw=1×10-13>10-14,所以t℃>25℃,
在t℃時將pH=11的溶液③a LNaOH 溶液與pH=1的溶液①H2SO4溶液b L混合(忽略混合后溶液體積的變化),NaOH 溶液中c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$=10-2mol/L,硫酸溶液中c(H+)=0.1mol/L,若所得混合溶液的pH=2,$\frac{0.1mol/L×bL-0.01mol/L×aL}{aL+bL}$=0.01mol∥l
a;b=9:2,
故答案為:>、a:b=9:2;
(5)室溫下,測得溶液⑤CH3COONH4 的pH=7,說明溶液呈中性,醋酸根離子水解顯堿性,銨根離子水解顯酸性,則說明CH3COO-的水解程度=NH4+的水解程度,
故答案為:=.
點評 本題考查了離子濃度大小的判斷,明確弱電解質的電離及鹽類水解特點是解本題關鍵,結合電解質強弱、溶液中的溶質解物料守恒、電荷守恒來分析解答,題目難度中等.


科目:高中化學 來源:2017屆貴州省高三上第四次模擬化學試卷(解析版) 題型:實驗題
在呼吸面具和潛水艇中可用過氧化鈉作為供氧劑。請用如圖實驗裝置,選用適當的化學試劑和實驗用品,設計并完成對過氧化鈉這一性質的探究。
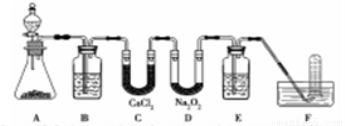
(1)A是實驗室制取CO2的裝置,其中發生反應的離子方程式是___________________;裝置B的作用是____________,裝置C的作用是____________,裝置E裝的試劑是___________。
(2)檢驗F中氣體成分,即能說明過氧化鈉可作潛水艇供氧劑,則過氧化鈉作潛水艇供氧劑的化學反應方程為___________________________。
(3)設計并完成ag過氧化鈉樣品(已知所含雜質與酸堿均不反應)的純度測定:將蒸餾水先加熱煮沸,再把蒸餾水分成兩份,一份中趁熱加入樣品溶解,待冷卻到室溫后再加入另一份水來進行配制。取出配制的溶液20.00mL,加入酚酞數滴后,用濃度為cmol/L的鹽酸進行滴定;重復滴定操作2次,計算出所用鹽酸的體積平均值為VmL。
①過氧化鈉樣品的純度測定步驟中,趁熱加入樣品溶解,理由是__________________。
②原過氧化鈉樣品的純度是________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省高二上第一次月考化學卷(解析版) 題型:填空題
下圖是元素周期表的一部分
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| B |
|
|
|
|
|
|
|
|
|
|
| C | D | E | F |
|
H |
|
|
|
|
|
|
|
|
|
|
| I |
| J |
| K | [Z |
|
|
|
| L |
|
|
| M |
|
|
|
|
|
|
| O |
|
(1)元素L的價電子排布圖為 ,元素M的原子結構示意圖為 ,位于元素周期表五個區域中的 區。上述元素中電負性最強的是 (用元素符號表示),C、D、E、F第一電離能的大小順序為 (用元素符號表示)。
(2)D的氫化物和J氫化物沸點較高的是 (填化學式),穩定性更強的是 (填化學式)。
(3)某些不同族元素的性質也有一定的相似性,如上表中元素I與元素B的氫氧化物有相似的性質。寫出元素B的氫氧化物與NaOH溶液反應的離子方程式 。
(4)A、E、H、J四種元素的原子半徑由大到小的排列順序為 (用元素符號表示);E、F、H、K四種元素簡單離子的半徑由大到小的排列順序為 (用元素符號表示)。
(5)能證明元素K比元素J的非金屬性強的事實是 (填序號)。
A.常溫下K單質的密度小于J單質的密度
B.K元素的氣態氫化物比J元素的氣態氫化物更穩定
C.K單質與氫氣反應的程度比J單質與氫氣反應的程度更劇烈
D.K元素的氧化物對應的水化物酸性強于J元素的氧化物對應的水化物
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應CO(g)+NO2(g)=CO2(g)+NO(g)△H<0,達平衡后,升高溫度體系顏色變深 | |
| B. | 實驗室制備氫氣,用粗鋅代替純鋅,反應速率加快 | |
| C. | 配制氯化鐵溶液時,將氯化鐵加入鹽酸中,然后加水稀釋 | |
| D. | 常溫下,將1mLpH=3的醋酸溶液加水稀釋至l00mL,測得其pH<5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 根據物質的組成和性質特點,可以將物質分成混合物和純凈物,漂白粉、鋼、水玻璃、液氨都為混合物 | |
| B. | 氨基酸、蛋白質、油脂、火棉中都含有C、H、O、N四種元素 | |
| C. | 李比希法可用于有機化合物組成中碳、氫元素質量分數的測定,同位素示蹤法可用于研究化學反應歷程機理 | |
| D. | 大豆蛋白、雞蛋白分別溶于水所形成的分散系為膠體,在熱、甲醛、飽和(NH4)2SO4溶液、X射線作用下,蛋白質的性質都會改變并發生變性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質類別 | 酸 | 堿 | 鹽 | 氧化物 | 氫化物 |
| 化學式 | ①HCl ②H2SO4 | ③NaOH ④Ba(OH)2 | ⑤Na2CO3 ⑥K2SO4 | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 以CH≡CH 和HCl 反應制氯乙烯,進而制備聚氯乙烯塑料 | |
| B. | 濃氨水滴入生石灰中,將產生的氣體通入AlCl3溶液,可得到含AlO2-的溶液 | |
| C. | 使用催化劑不能改變工業合成NH3的反應限度 | |
| D. | 用浸有KMnO4溶液的硅土來吸收水果釋放的乙烯 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如表所列各組物質中,物質之間通過一步反應不能實現如圖所示轉化的是( )
如表所列各組物質中,物質之間通過一步反應不能實現如圖所示轉化的是( )| 選項 | a | b | c |
| A | Fe | FeCl3 | FeCl2 |
| B | HCl | Cl2 | HClO |
| C | H2SO4 | SO2 | SO3 |
| D | CH2=CH2 | CH3CH2OH | CH3CHO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com