
| A. | 已知氯化鈷及其水合物會呈現不同顏色(如下),德國科學家發明了添加氯化鈷的變色水泥,據此推測雨天變色水泥呈粉紅色 | |
| B. | 已知鉻酸根(黃色)和重鉻酸根(橙色)離子間存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O,若加水稀釋,則溶液中所有離子濃度均減少 | |
| C. | 若反應2A(g)+B(s)?C(g)+3D(g)只有高溫下才能自發進行,則該反應的△H>0 | |
| D. | 增大反應物的濃度,可使單位體積內活化分子數目增多,反應速率加快 |
分析 A、雨天時溫度相對較低,濕度大,平衡向左移動;
B、加水稀釋,平衡向右移動,Cr2O72-物質的量增大;
C、正反應為熵增過程,△G=△H-T△S<0自發進行,據此判斷;
D、增大反應物濃度,活化分子濃度增大,反應速率增大.
解答 解:A.雨天時溫度相對較低,濕度大,平衡向左移動,主要為CoCl2•6H2O,呈粉紅色,故A正確;
B.加水稀釋,溶液中各離子濃度都降低,但平衡向右移動,Cr2O72-物質的量增大,故B錯誤;
C.正反應為熵增過程,在高溫下自發進行,則高溫下△G=△H-T△S<0,可以推斷△H>0,故C正確;
D.增大反應物濃度,單位體積內活化分子的數目增大,有效碰撞的次數增多,反應速率增大,故D正確;
故選B.
點評 本題考查平衡移動影響因素、反應進行方向、活化分子等,難度不大,B選項為易錯點,容易將濃度與物質的量混淆,可以根據平衡常數理解平衡移動方向.


科目:高中化學 來源: 題型:選擇題
| A. | 30g二氧化硅晶體中含有Si-O鍵數目為2NA | |
| B. | 標準狀況下,2.24L CHCl3的原子總數為0.1NA | |
| C. | 一定條件下,將1molN2與3molH2混合反應后,生成NH3分子的數目為2NA | |
| D. | 常溫下,0.1mol/LNH4NO3溶液NO${\;}_{3}^{-}$的數目為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 23g鈉與足量氧氣充分反應,轉移的電子個數為NA | |
| B. | 將1molFeCl3水解制成膠體,所得膠體的微粒數為NA | |
| C. | 1mol Na2O2與水完全反應時轉移電子數為2NA | |
| D. | NA個一氧化碳分子和0.5 mol甲烷的質量比為7:4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | X | Y | Z |
| ① | N2 | Mg | CO2 |
| ② | KOH溶液 | SiO2 | 氫氟酸 |
| ③ | O2 | N2 | H2 |
| ④ | 稀硝酸 | Fe | FeCl3溶液 |
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 共價化合物中一定不含有離子鍵,離子化合物中可能含有共價鍵 | |
| B. | 充電電池的化學反應原理是氧化還原反應 | |
| C. | 一定條件下,將1 mol N2與3 mol H2充入密閉容器中充分反應可生成2 mol NH3 | |
| D. | 質子數相同、電子數也相同的兩種微粒,不可能是一種分子和一種離子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 42g乙烯和丙烯的混合氣體中碳原子數目一定為3NA. | |
| B. | 用惰性電極電解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液復原,則電解時產生標準狀況下1.12L的氣體 | |
| C. | 配制一定物質的量濃度的NaOH溶液,把NaOH固體于燒杯中充分溶解,并迅速轉移到容量瓶中定容 | |
| D. | 30g的NO與O2充分反應后,生成的氣體分子數為1NA. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | B. | c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | ||
| C. | 2c(SO42-)+c(OH-)=c(NH4+)+2c(Fe2+)+c(H+) | D. | c(NH4+)+c(NH3•H2O)=2c(Fe2+)+2c(SO42-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
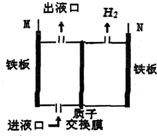 如圖所示,某工廠采用電解法處理含鉻(Cr2O72-)酸性廢水,其中,耐酸電解槽以鐵板作陰、陽極,電解后,溶液中的Cr2O72-全部變為Cr3+,下列說法不正確的是( )
如圖所示,某工廠采用電解法處理含鉻(Cr2O72-)酸性廢水,其中,耐酸電解槽以鐵板作陰、陽極,電解后,溶液中的Cr2O72-全部變為Cr3+,下列說法不正確的是( )| A. | M與電源的正極相連 | B. | 出液口排出的溶液中還含有Fe3+ | ||
| C. | N極電極反應為2H++2e-═H2↑ | D. | 陰極區附近溶液pH降低 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯不能使酸性高錳酸鉀溶液褪色 | |
| B. | 苯不能使酸性高錳酸鉀溶液褪色 | |
| C. | 乙醇可以和金屬鈉反應放出氫氣 | |
| D. | 乙酸可以與乙醇在一定條件下發生酯化反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com