
| A. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | B. | c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | ||
| C. | 2c(SO42-)+c(OH-)=c(NH4+)+2c(Fe2+)+c(H+) | D. | c(NH4+)+c(NH3•H2O)=2c(Fe2+)+2c(SO42-) |
分析 莫爾鹽的化學式為(NH4)2Fe(SO4)2,(NH4)2Fe(SO4)2完全電離:(NH4)2Fe(SO4)2=2NH4++Fe2++2SO42-,因NH4+、Fe2+水解,導致c(NH4+)、c(Fe2+)濃度減小,則c(SO42-)>c(NH4+)>c(Fe2+),水解后溶液呈酸性,則c(H+)>c(OH-),溶液中離子濃度大小為:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-);溶液中滿足電荷守恒:2c(SO42-)+c(OH-)=c(NH4+)+2c(Fe2+)+c(H+)、物料守恒:c(NH4+)+c(NH3•H2O)=2c(Fe2+)+2c(SO42-),據此進行判斷.
解答 解:莫爾鹽的化學式為(NH4)2Fe(SO4)2,(NH4)2Fe(SO4)2完全電離:(NH4)2Fe(SO4)2=2NH4++Fe2++2SO42-,
A.NH4+、Fe2+部分水解,且水解程度較小,導致c(NH4+)、c(Fe2+)濃度減小,則c(SO42-)>c(NH4+)>c(Fe2+),水解后溶液呈酸性,則c(H+)>c(OH-),溶液中離子濃度大小為:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-),故A正確;
B.由于銨根離子部分水解,導致c(NH4+)減小,則c(SO42-)>c(NH4+),故B錯誤;
C.根據溶液中的電荷守恒可得:2c(SO42-)+c(OH-)=c(NH4+)+2c(Fe2+)+c(H+),故C正確;
D.根據溶液中的物料守恒可得:c(NH4+)+c(NH3•H2O)=2c(Fe2+)+2c(SO42-),故D正確;
故選B.
點評 本題考查了離子濃度大小比較,題目難度中等,明確電荷守恒、物料守恒的含義為解答關鍵,注意掌握鹽的水解原理,能夠根據電荷守恒、物料守恒及鹽的水解原理判斷溶液中離子濃度大小.


科目:高中化學 來源: 題型:選擇題
| A. | 凡金屬跟非金屬元素化合時都能形成離子鍵 | |
| B. | 離子化合物熔融狀態下一定導電 | |
| C. | 離子化合物中的陽離子只能是金屬離子,酸根離子中不能含有金屬元素 | |
| D. | 溶于水可以導電的化合物一定是離子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.0015 g•cm-3 | B. | 0.0012 g•cm-3 | C. | 0.0024 g•cm-3 | D. | 0.002 g•cm-3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 已知氯化鈷及其水合物會呈現不同顏色(如下),德國科學家發明了添加氯化鈷的變色水泥,據此推測雨天變色水泥呈粉紅色 | |
| B. | 已知鉻酸根(黃色)和重鉻酸根(橙色)離子間存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O,若加水稀釋,則溶液中所有離子濃度均減少 | |
| C. | 若反應2A(g)+B(s)?C(g)+3D(g)只有高溫下才能自發進行,則該反應的△H>0 | |
| D. | 增大反應物的濃度,可使單位體積內活化分子數目增多,反應速率加快 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
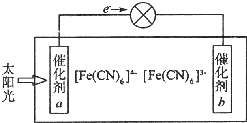 鐵、銅等金屬及其化合物在日常生活中應用廣泛,回答下列問題.
鐵、銅等金屬及其化合物在日常生活中應用廣泛,回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 羥基的電子式: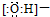 | B. | 硫原子的原子結構示意圖: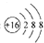 | ||
| C. | 乙烯分子的實驗式:C2H4 | D. | 3,3一二甲基一1一戊烯的鍵線式: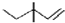 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 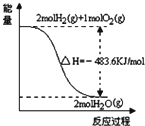 表示H2與O2發生反應過程中的能量變化,則H2的燃燒熱為-241.8kJ•mol-1 | |
| B. | 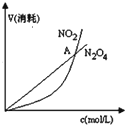 表示恒溫恒容條件下發生的可逆反應2NO2(g)═N2O4(g)中,各物質的濃度與其消耗速率之間的關系,其中交點A對應的狀態為化學平衡狀態 | |
| C. | 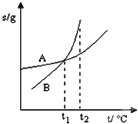 表示A、B兩物質的溶解度隨溫度變化情況,將tl℃時A、B的飽和溶液分別升溫至t2℃時,溶質的質量分數B>A | |
| D. | 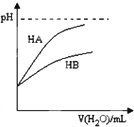 表示常溫下,稀釋HA、HB兩種酸的稀溶液時,溶液pH隨加水量的變化.則NaA溶液的pH小于等物質的量濃度的NaB溶液的pH |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 石灰乳與Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ | |
| B. | AlCl3溶液中加入過量的濃氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | NaHCO3和過量的澄清石灰水反應:2HCO3-+2OH-+Ca2+═CaCO3↓+CO32-+2H2O | |
| D. | NH4HSO3溶液與足量NaOH溶液混合加熱:NH4++HSO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+SO32-+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com