
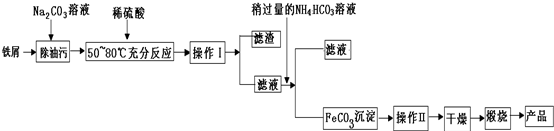
分析 碳酸鈉溶液顯堿性,可以除去鐵屑表面的油污,用稀硫酸溶解鐵,再通過過濾分離得到濾液,濾液中加入碳酸氫銨,將溶液中亞鐵離子轉化為FeCO3沉淀,再通過過濾分離濾液與FeCO3,濾液中含有硫酸銨,FeCO3表面附著雜質,在干燥前應先洗滌除去雜質,在空氣中煅燒分解,且+2價鐵在空氣中加熱易被氧化為+3價,最終得到Fe2O3,
(1)①操作I后得到濾渣和濾液,應為過濾;沉淀干燥前應先洗滌除去雜質;
②FeCO3與氧氣反應生成三氧化二鐵和二氧化碳;
③依據煅燒反應不完全,生成氧化鐵中含有碳酸亞鐵,可以先加酸溶解,再加入高錳酸鉀溶液檢驗亞鐵離子的存在;
(2)①高錳酸根具有強氧化性,亞鐵離子具有還原性,酸性條件下,高錳酸根將亞鐵離子氧化為鐵離子,自身被還原為錳離子,同時有水生成;
②亞鐵離子被氧化為三價鐵離子,高錳酸鉀溶液做指示劑,滴定終點時溶液由淺綠色變為紫紅色,且半分鐘內不立即褪去;
③根據n=cV計算25mL樣品溶液消耗高錳酸鉀的物質的量,進而計算250mL溶液可以消耗高錳酸鉀的物質的量,再根據①中離子方程式計算亞鐵離子的物質的量,由Fe元素守恒可得FeSO4•7H2O的物質的量,根據m=nM計算FeSO4•7H2O的質量,進而計算其質量分數.
解答 解:碳酸鈉溶液顯堿性,可以除去鐵屑表面的油污,用稀硫酸溶解鐵,再通過過濾分離得到濾液,濾液中加入碳酸氫銨,將溶液中亞鐵離子轉化為FeCO3沉淀,再通過過濾分離濾液與FeCO3,濾液中含有硫酸銨,FeCO3表面附著雜質,在干燥前應先洗滌除去雜質,在空氣中煅燒分解,且+2價鐵在空氣中加熱易被氧化為+3價,最終得到Fe2O3,
(1)①操作I分離互不相溶的固體與液體,采取過濾;碳酸亞鐵表面附著雜質,沉淀干燥前應先洗滌除去雜質,判斷操作Ⅱ進行完全的方法是,取最后一次洗滌液少量于試管中滴入濃氫氧化鈉溶液加熱,無使紅色石蕊試紙變藍色的氣體生成,證明洗滌干凈,
故答案為:過濾;取最后一次洗滌液少量于試管中滴入濃氫氧化鈉溶液加熱,無使紅色石蕊試紙變藍色的氣體生成,證明洗滌干凈;
②在空氣中煅燒FeCO3的化學方程式為4FeCO3+O2$\frac{\underline{\;高溫\;}}{\;}$2Fe2O3+4CO2,
故答案為:4FeCO3+O2$\frac{\underline{\;高溫\;}}{\;}$2Fe2O3+4CO2;
③煅燒如果不充分,產品中將有Fe2+ 存在,主要是Fe2O3和FeCO3,取樣品放入試管中,加入稀硫酸溶解得到溶液,滴入高猛酸鉀溶液,若滴入的高錳酸鉀溶液褪色證明含有亞鐵離子,否則不存在,
故答案為:取固體樣品少許放入試管中,加入足量稀硫酸,震蕩試管,再加入幾滴滴入KMnO4溶液,若溶液褪色證明含有Fe2+,否則不存在;
(2)①高錳酸根具有強氧化性,亞鐵離子具有還原性,酸性條件下,高錳酸根將亞鐵離子氧化為鐵離子,自身被還原為錳離子,同時有水生成,反應離子方程式為:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
故答案為:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
②滴定實驗是利用高錳酸鉀溶液的顏色變化指示反應終點,所以反應完全后,滴入最后一滴溶液,溶液呈紫紅色且半分鐘不褪色,證明反應達到終點,
故答案為:滴入最后一滴溶液,溶液呈紫紅色且半分鐘不褪色,證明反應達到終點;
③25mL樣品溶液消耗高錳酸鉀的物質的量為0.02L×0.0100mol/L=2×10-4mol,可知250mL溶液可以消耗高錳酸鉀的物質的量為2×10-4mol×$\frac{250ml}{25ml}$=2×10-3mol,由5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,可知250mL溶液中亞鐵離子離子的物質的量為2×10-3mol×5=0.01mol,由Fe元素守恒可得FeSO4•7H2O的物質的量為0.01mol,
故FeSO4•7H2O的質量分數為:$\frac{0.01mol×278g/mol}{2.85g}$×100%=97.54%,
故答案為:97.54%.
點評 本題通過化學工藝流程考查探究物質組成、測量物質含量的方法,題目難度中等,明確實驗目的、實驗原理為解答關鍵,注意分析試劑線、操作線、反應線,是對學生綜合能力的考查,需要學生具備扎實的基礎.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
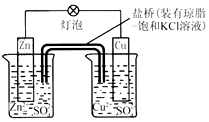
| A. | 負極反應為:2n-2e -═2n2+ | B. | 電池反應為:Zn+Cu2+═Zn2++Cu | ||
| C. | 鹽橋中酌K+移向ZnSO4溶液 | D. | 在外電路中,電子從負極流向正極 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
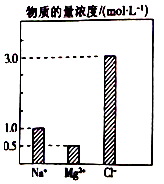 在0.2L由NaCl、MgCl2、BaCl2組成的混合溶液中,部分離子濃度大小如圖所示,對于該溶液成分,下列說法不正確的是( )
在0.2L由NaCl、MgCl2、BaCl2組成的混合溶液中,部分離子濃度大小如圖所示,對于該溶液成分,下列說法不正確的是( )| A. | NaCl的物質的量為0.2mol | |
| B. | 溶質MgCl2的質量為9 g | |
| C. | 該混合液中BaCl2的物質的量為0.1mol | |
| D. | 將該混合液加水稀釋至體積為1 L,稀釋后溶液中的Ba2+物質的量濃度為0.1mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
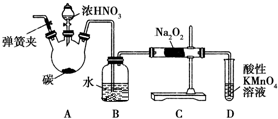 亞硝酸鈉(NaNO2)被稱為工業鹽,在漂白、電鍍等方面應用廣泛.以木炭、濃硝酸、水和銅為原料制備亞硝酸鈉的裝置如圖所示.已知:室溫下,①2NO+Na2O2═2NaNO2;②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;③酸性條件下,NO或NO2-都能與MnO4-反應生成NO3-和Mn2+.
亞硝酸鈉(NaNO2)被稱為工業鹽,在漂白、電鍍等方面應用廣泛.以木炭、濃硝酸、水和銅為原料制備亞硝酸鈉的裝置如圖所示.已知:室溫下,①2NO+Na2O2═2NaNO2;②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;③酸性條件下,NO或NO2-都能與MnO4-反應生成NO3-和Mn2+.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
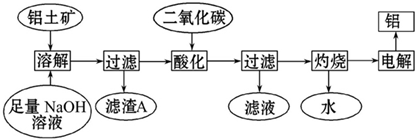
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
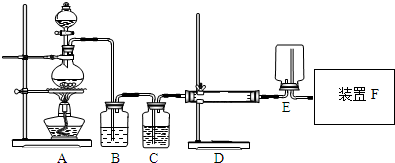

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
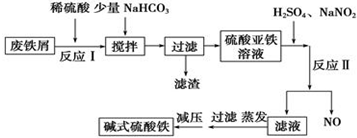
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 開始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
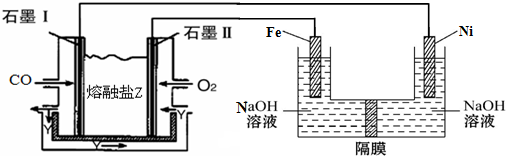
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,正丁烷的燃燒熱為-2878.0 kJ/mol | |
| B. | 相同質量的丙烷和丁烷分別完全燃燒,前者需要的氧氣多,產生的熱量也多 | |
| C. | 常溫下,CO的燃燒熱為566.0 kJ/mol | |
| D. | 人類利用的能源都是通過化學反應獲得的 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com