
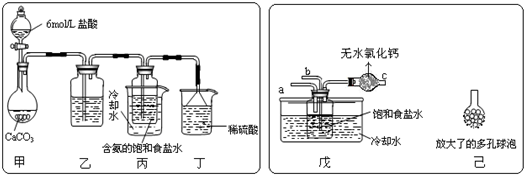
分析 (Ⅰ)依據題干中信息碳酸氫鈉溶解度相對較小分析判斷;
(Ⅱ)(1)①依據用鹽酸制取二氧化碳時常會含有氯化氫氣體分析即可解答;
②依據稀硫酸能與氨氣反應分析解答;
③依據分離固體與液體采用的實驗操作分析解答,過濾操作可需要的主要儀器是漏斗、燒杯、玻璃棒及鐵架臺等;
(2)①根據氨氣易溶于水,從制取碳酸氫鈉時先要得到含氨的飽和食鹽水分析解答;
②從裝置改動后反應物的接觸面積變大分析判斷.
解答 解:(Ⅰ)A.碳酸氫鈉易溶于水,故錯誤;
B.碳酸氫鈉受熱易分解,與其在溶液中首先結晶析出無關,故錯誤;
C.碳酸氫鈉的溶解度相對于氯化銨來說碳酸氫鈉的溶解度更小一些,所以在溶液中首先結晶析出,故正確;
故答案為:C;
(Ⅱ)(1)①利用鹽酸制取二氧化碳時,因鹽酸易揮發,所以,二氧化碳中常會含有氯化氫氣體,碳酸氫鈉能與鹽酸反應不與二氧化碳反應,所以通過碳酸氫鈉的溶液是可以除掉二氧化碳氣體中的氯化氫氣體,故答案為:飽和碳酸氫鈉溶液;
②實驗過程中氨氣可能有剩余,而稀硫酸能與氨氣反應,所以稀硫酸的作用是吸收末反應的NH3,故答案為:吸收未反應的NH3;
③分離出NaHCO3晶體的操作是分離固體與液體,常采用的實驗操作是過濾操作,此操作需要的玻璃儀器有玻璃棒、漏斗及燒杯,故答案為:過濾;玻璃棒;漏斗;燒杯;
(2)①制取碳酸氫鈉時先要得到含氨的飽和食鹽水,氨氣極易溶于水,二氧化碳能溶于水,則應先通入氨氣,能形成較大濃度的溶液,有利于二氧化碳吸收,生成更多的碳酸氫銨,故a端通入NH3,故答案為:NH3;氨氣極易溶解于水,能形成較大濃度的溶液,有利于二氧化碳吸收,生成更多的碳酸氫銨;
②裝置改動后反應物的二氧化碳與溶液的接觸面積變大,提高了二氧化碳的吸收率,故答案為:增大氣體與溶液接觸面積,提高CO2吸收率.
點評 本題主要考查“侯氏制堿法”的反應原理,題目較為綜合,難度較大,解答須明晰制堿的原理.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 10℃20mL 3 mol•L-1的NaHCO3溶液 | B. | 20℃30mL 2 mol•L-1的NaHCO3溶液 | ||
| C. | 20℃10mL 4 mol•L-1的NaHCO3溶液 | D. | 10℃10mL 2 mol•L-1的NaHCO3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,4.4g CO2物質的量為0.1mol | |
| B. | 常溫常壓下,6.2g Na2O含有的Na+離子數為0.1mol | |
| C. | 標準狀況下,1NA個H2O分子含有氧分子數為1mol | |
| D. | 標準狀況下,22.4L酒精的物質的量為1mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 無色氣體的質量為0.2g | |
| B. | 原混合物中鐵的質量分數無法計算 | |
| C. | 實驗中消耗的H2SO4物質的量為0.1mol | |
| D. | 溶液中金屬離子物質的量為0.02mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
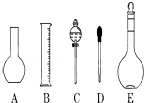 實驗室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根據這兩種溶液的配制情況回答下列問題:
實驗室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根據這兩種溶液的配制情況回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 制純堿:往NaOH溶液中 通入少量CO2氣體,再蒸發溶液 | |
| B. | 制氯氣:以粗鹽為原料,經過除雜、濃縮得飽和食鹽水,再進行電解所得溶液 | |
| C. | 制鎂:用海水為原料,經一系列過程制得氧化鎂固體,再用H2還原得鎂 | |
| D. | 制鋁:從鋁土礦中獲得氧化鋁再得到氯化鋁固體,電解熔融的氯化鋁得到鋁 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
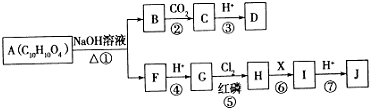
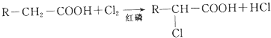
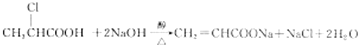 .
.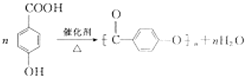 .
. .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com