
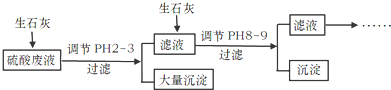
分析 硫酸廢液中含有大量硫酸外,還含有少量NH4+、Fe3+、AsO43-、Cl-,加入生石灰,調節pH2~3,大量沉淀主要成分為CaSO4•2H2O[含有少量Fe(OH)3],濾液加入生石灰調節pH8~9,生成Ca3(AsO4)2沉淀,濾液主要含有(NH4)2SO4和NH4Cl,
(1)根據c(NH4+)越大,NH4+水解程度越小判斷;
(2)隨著向廢液中投入生石灰,c(OH-)增大,c(NH3•H2O)減小;
(3)提純CaSO4•2H2O,可加入稀硫酸溶解Fe(OH)3,并洗滌、干燥;
(4)①H3AsO4是弱酸電離出來的AsO43-較少,所以酸性條件下不易形成Ca3(AsO4)2沉淀;
②依據水解常數與電離常數及Kw的關系計算;
③根據還原劑還原性大于還原產物的還原性判斷.
解答 解:硫酸廢液中含有大量硫酸外,還含有少量NH4+、Fe3+、AsO43-、Cl-,加入生石灰,調節pH2~3,大量沉淀主要成分為CaSO4•2H2O[含有少量Fe(OH)3],濾液加入生石灰調節pH8~9,生成Ca3(AsO4)2沉淀,濾液主要含有(NH4)2SO4和NH4Cl,
(1)如c[(NH4)2SO4]=c(NH4Cl),則(NH4)2SO4溶液中c(NH4+)較大,因c(NH4+)越大,NH4+水解程度越小,則(NH4)2SO4溶液中c(NH4+)小于是NH4Cl溶液中c(NH4+)的2倍,如等于2倍,則c(NH4Cl)應較大,
故答案為:<;
(2)隨著向廢液中投入生石灰,c(OH-)增大,c(NH3•H2O)減小,則溶液中$\frac{[N{H}_{3}•{H}_{2}O]}{[O{H}^{-}]}$減小,故答案為:減小;
(3)提純CaSO4•2H2O,可加入稀硫酸溶解Fe(OH)3,且防止CaSO4•2H2O的溶解,過濾后洗滌、干燥,
故答案為:稀硫酸;晾干或干燥;
(4)①H3AsO4是弱酸電離出來的AsO43-較少,所以酸性條件下不易形成Ca3(AsO4)2沉淀,當溶液中pH調節到8左右時AsO43-濃度增大,Ca3(AsO4)2開始沉淀,
故答案為:H3AsO4是弱酸,當溶液中pH調節到8左右,c(AsO43-)增大,Ca3(AsO4)2開始沉淀;
②Na3AsO4的第一步水解的離子方程式為:AsO43-+H2O?HAsO42-+OH-,該步水解的平衡常數Kh=$\frac{c(HAs{{O}_{4}}^{2-})•c(OH{\;}^{-})}{c(As{O}_{4}{\;}^{3-})}$=$\frac{c(HAsO{{\;}_{4}}^{2-})•c(OH{\;}^{-})•c(H{\;}^{+})}{c(AsO{{\;}_{4}}^{3-})•c(H{\;}^{+})}$=$\frac{Kw}{K{\;}_{3}}$=$\frac{10{\;}^{-14}}{4.0×10{\;}^{-12}}$=2.5×10-3,
故答案為:2.5×10-3;
③已知:AsO43-+2I-+2H+=AsO33-+I2+H2O,SO2+I2+2H2O=SO42-+2I-+4H+.還原劑還原性大于還原產物的還原性,則還原性SO2>I->AsO33-,兩個反應中還原性最強的微粒是SO2,
故答案為:SO2.
點評 本題考查較為綜合,側重于學生的分析、實驗和計算能力的考查,注意把握溶液中濃度的換算,沉淀溶解平衡的溶度積常數計算,水解常數和電離常數的計算,離子方程式的書寫,沉淀的形成等,考查的知識點較多,題目難度中等.


科目:高中化學 來源: 題型:選擇題
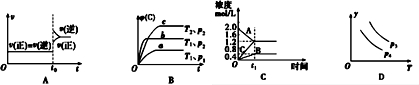
| A. | 對于達到平衡狀態的N2(g)+3H2(g)?2NH3 (g)在t0時刻充入了一定量的NH3,平衡逆向移動 | |
| B. | 對于反應 2A(g)+B(g)?C(g)+D(g)△H<0,p2>p1,T1>T2 | |
| C. | 該圖象表示的化學方程式為:2A═B+3C | |
| D. | 對于反應 2X(g)+3Y(g)?2Z(g)△H<0,y可以表示Y的百分含量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化石燃料燃燒和工業廢氣中的氮氧化物均是導致“霧霾天氣”的元兇 | |
| B. | 天津港爆炸事件中可知,當電石、鈉、氰化鈉等物品遇到明火時,應迅速用水澆滅 | |
| C. | 新發現一種固態碳,外形似海綿,密度小,有磁性,其與金剛石的關系是同素異形體 | |
| D. | 熱的純堿溶液去除廚房油污效果比冷的純堿溶液效果好 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
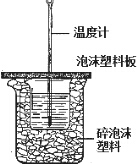 用如圖所示裝置進行中和熱測定實驗,請回答下列問題:
用如圖所示裝置進行中和熱測定實驗,請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.5 mol•L-1 NaOH溶液中Na+數為0.5NA | |
| B. | 標準狀況下,22.4 L四氯化碳含有的分子數為NA | |
| C. | 常溫常壓下,1mol Na2O2與足量CO2反應,電子轉移數為NA | |
| D. | 標準狀況下,16 g氧氣臭氧的混合氣體所含原子數一定為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
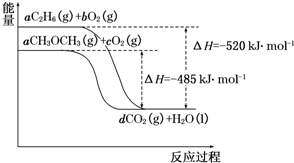 當今世界,能源的發展日益成為全世界、全人類共同關心的問題.如圖是乙烷(C2H6)、二甲醚(CH3OCH3)燃燒過程的能量變化圖.請回答下列問題:
當今世界,能源的發展日益成為全世界、全人類共同關心的問題.如圖是乙烷(C2H6)、二甲醚(CH3OCH3)燃燒過程的能量變化圖.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com