
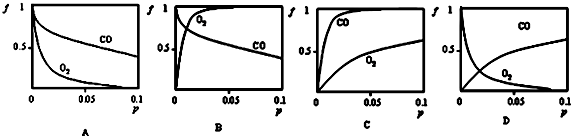

分析 (1)Mb(aq)+X(g)?MbX(aq),增大壓強,平衡正向移動,因此無論是CO還是O2,隨著壓強的增大,結合率(f)都是逐漸增大;肌紅蛋白與CO結合反應的平衡常數K(CO)遠大于與O2結合的平衡常數K(O2),說明肌紅蛋白與CO的結合能力比其與O2的結合能力強;
(2)①設平衡時吸附小分子的肌紅蛋白(MbX)的濃度為[MbX],肌紅蛋白(Mb)的濃度為[Mb],根據K的概念代入表達式;
②令Mb起始濃度為1,根據三段式:
Mb(aq)+O2(g)?MbO2(aq)
起始:1 0
轉化:α α
平衡:1-α α
K=$\frac{c(Mb{O}_{2})}{c(Mb)•P({O}_{2})}$=$\frac{α}{(1-α)P({O}_{2})}$,根據圖2,p(O2)=2.0kPa,α=80%,代入計算.
解答 解:(1)對于Mb(aq)+X(g)?MbX(aq),增大壓強,平衡正向移動,因此無論是CO還是O2,隨著壓強的增大,結合率(f)都是逐漸增大.在常溫下,肌紅蛋白與CO結合反應的平衡常數K(CO)遠大于與O2結合的平衡常數K(O2),說明肌紅蛋白與CO的結合能力比其與O2的結合能力強,所以相同壓強條件下,肌紅蛋白與CO的結合率(f)更大,因此C圖象符合,
故答案為:C;
(2)①設平衡時吸附小分子的肌紅蛋白(MbX)的濃度為[MbX],肌紅蛋白(Mb)的濃度為[Mb],則對于Mb(aq)+X(g)?MbX(aq),平衡常數K=$\frac{[MbX]}{[Mb]•\frac{p}{{p}_{0}}}$,所以[Mb]=$\frac{[MbX]}{K•\frac{p}{{p}_{0}}}$,所以吸附小分子的肌紅蛋白(MbX)占總肌紅蛋白的比例為$\frac{[MbX]}{[MbX]+[Mb]}$,將[Mb]代入整理可得,比例為$\frac{pK}{pK+{p}_{0}}$;
故答案為:$\frac{pK}{pK+{p}_{0}}$;
②令Mb起始濃度為1,根據三段式:
Mb(aq)+O2(g)?MbO2(aq)
起始:1 0
轉化:α α
平衡:1-α α
K=$\frac{c(Mb{O}_{2})}{c(Mb)•P({O}_{2})}$=$\frac{α}{(1-α)P({O}_{2})}$,根據圖2,p(O2)=2.0kPa,α=80%,K=$\frac{0.8}{(1-0.8)×2}$=2.00;
故答案為:2.00.
點評 本題考察化學反應原理的載體一改工業合成的慣例,采用人體中氣體分子與蛋白結合的平衡模型,非常新穎.本題的思維含量很高,計算量也不小,特別是第(2)題要求對平衡常數的運算式熟練掌握,并且引入平衡分壓概念,適當拓展,全面思考的能力.此題難度很大.


科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 物質 | CH3OH | CH3OCH3 | H2O |
| 濃度/mol•L-1 | 0.64 | 0.50 | 0.50 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 汽車尾氣是城市的主要空氣污染物,研究控制汽車尾氣成為保護環境的首要任務.
汽車尾氣是城市的主要空氣污染物,研究控制汽車尾氣成為保護環境的首要任務. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H | ||||
| 4 | J | K |
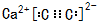 ,
,查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學式 | △H/(kJ?mol-1) | 化學式 | △H/(kJ?mol-1) |
| CO(g) | -283.0 | CH4(g) | -890.3 |
| H2(g) | -285.8 | CH3OH(l) | -726.5 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com