
分析 (1)根據水的硬度是由鈣和鎂的硫酸鹽或氯化物等引起的,這種硬度叫做永久硬度;根據除雜時不能引入新的雜質;
(2)①根據Ca(HCO3)2和Mg(HCO3)2的性質分析水垢形成的過程、寫出水垢形成的過程的化學方程式;
②反應生成的二氧化碳能溶于水,要加熱除去;
③EDTA標準溶液的濃度和消耗的體積,求出金屬離子的物質的量,再求出氧化鈣的質量和水的硬度;
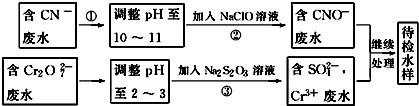
(3)①堿性條件下,CN-離子與NaClO發生氧化還原反應生成CNO-、Cl-離子,據此寫出離子方程式;
②Cr3+廢水有毒,可使Cr3+生成沉淀過濾除去.
解答 解:(1)因水的硬度是由鈣和鎂的硫酸鹽或氯化物等引起的,這種硬度叫做永久硬度;已知水中主要含Ca2+、Mg2+、Cl-和SO42-,則該硬水的硬度屬于永久硬度;因除雜時不能引入新的雜質,過量的鈣離子通過純堿來除去,故先加石灰,后加純堿,
故答案為:永久; 石灰;純堿;
(2)①由于自然界的水中大都溶有一定量的Mg(HCO3)2,在受熱時生成Mg(OH)2,這種白色固體在容器內壁上積淀,即形成水垢,所以水垢形成的過程的方程式為Mg(HCO3)2=Mg(OH)2↓+2CO2↑,故答案為:Mg(HCO3)2=Mg(OH)2↓+2CO2↑;
②預處理的方法是向水樣中加入濃鹽酸,鹽酸與Mg(HCO3)2反應生成二氧化碳,CO2能溶于水,所以要加熱煮沸除去,故答案為:除去溶解的CO2;
③根據已知反應可知滴定前溶液為酒紅色,滴定結束后為藍色,所以溶液顏色變化為酒紅色變為藍色;
用0.01000mol•L-1的EDTA標準溶液進行滴定,滴定終點時共消耗EDTA溶液15.00mL,則n(M2+)=n(EDTA)=0.01000mol•L-1×15.00×10-3=1.5×10-4mol,
則25ml水中m(CaO)=nM=56g/mol×1.5×10-4mol=8.2mg,所以1L水中m(CaO)=8.2mg×1000÷25=336mg,通常把1L水中含有10mg CaO稱為1度,所以該地下水的硬度為336mL÷10mL=33.6度,
故答案為:33.6度;
(3)①步驟②中,無氣體放出,CN-被ClO-氧化為CNO-,則因為是在堿性環境中,故ClO-只能被還原為Cl-,反應式為:CN-+ClO-═CNO-+Cl-;
故答案為:CN-+ClO-═CNO-+Cl-;
②Cr3+廢水有毒,可使Cr3+生成沉淀過濾除去,故調節廢水pH,使其轉化成Cr(OH)3沉淀除去,故答案為:調節廢水pH,使其轉化成Cr(OH)3沉淀除去.
點評 本題是一道化學和生活相結合的題目,注重知識的遷移應用,難度不大,能較好的考查學生分析和解決問題的能力.


 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案科目:高中化學 來源: 題型:解答題
| 實驗組號 | ① | ② | ③ | ④ |
| 碳化物(g) | 6.2 | 9.3 | 15.5 | 21.7 |
| 水(mL) | 18 | 18 | 18 | 18 |
| 氣體(L,標準狀況) | 3.36 | 5.04 | 8.4左右 | 8.4左右 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 堿性:NaOH>Mg(OH)2 | B. | 熱穩定性:Na2CO3>NaHCO3 | ||
| C. | 金屬性:Na>Mg | D. | 水中溶解性:Mg(OH)2>Na2CO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
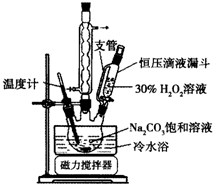 2Na2CO3•3H2O2是一種新型的氧系漂白劑.某實驗興趣小組進行了如下實驗.
2Na2CO3•3H2O2是一種新型的氧系漂白劑.某實驗興趣小組進行了如下實驗.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 甲烷、甲醇、CO、H2、CO2均是重要的化工原料.
甲烷、甲醇、CO、H2、CO2均是重要的化工原料.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 物質 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.00084 | 0.01 |
| A. | 已知MgCO3的KSp=6.82×10-6mol2•L-2,則所有含有固體MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6mol2•L-2 | |
| B. | 除去粗鹽中含有的MgCl2雜質,最佳除雜試劑為Na2CO3溶液 | |
| C. | 將表中三種物質分別與水混合,分別加熱、灼燒,最終的固體產物相同 | |
| D. | 用足量石灰水處理含有Mg2+和HCO3-的硬水,發生的離子反應方程式為Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 乙酸乙酯和水、酒精和水、植物油和水 | |
| B. | 四氯化碳和水、溴苯和水、硝基苯和水 | |
| C. | 甘油和水、乙酸和乙醇、乙酸和水 | |
| D. | 水和植物油、己烷和水、苯和水 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
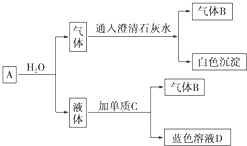
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com