
分析 (1)堿抑制水電離,含有弱酸根離子的鹽促進水電離,所以氫氧化鈉溶液中水電離出的c(OH-) 等于C(H+),醋酸鈉溶液中水電離出的c(OH-) 等于水離子積常數與C(H+)的比值;
(2)等體積、等pH的Ba(OH)2、NaOH中,c(OH-)相同,但NH3•H2O為弱堿,等pH時,其濃度大于NaOH,然后結合酸堿中和時c(OH-)越大,消耗酸越多;
(3)(NH4)2A溶液是中性,說明NH4+和A2-離子水解程度相等,則一水合氨和H2A電離平衡常數相等,H2A溶液加入到Na2CO3溶液中有氣體放出,說明H2A酸性大于H2CO3,則CO32-水解程度大于NH4+;
(4)化鐵水解呈酸性,可使碳酸鈣溶解生成二氧化碳氣體,溶液中水解平衡正向進行生成;飽和氯化鐵溶液中存在Fe3++3H2O?Fe(OH)3+3H+,若生成氣體和紅褐色沉淀,平衡正向進行,且加入的物質和酸反應放出氫氣;
(5)①根據溶度積常數計算各沉淀生成時所需銀離子的濃度;
②計算出溴離子、碘離子濃度分別為1.0×10-5mol/L時銀離子濃度,然后根據氯化銀開始沉淀時銀離子濃度進行比較,即可判斷當AgC1沉淀開始析出時,溶液中的Br-、I-是否完全沉淀.
解答 解:(1)氫氧化鈉抑制水電離,醋酸鈉促進水電離,所以氫氧化鈉溶液中水電離出的c(OH-)等于c(H+),醋酸鈉溶液中水電離出的c(OH-)等于水離子積常數與C(H+)的比值,則氫氧化鈉溶液中水電離出的c(OH-)=10-13 mol/L,醋酸鈉溶液中水電離出的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=10-4 mol/L,所以a:b=10-13:10-4=1:109;
故答案為:1:109;
(2)等體積、等pH的Ba(OH)2、NaOH中,c(OH-)相同,滴加等濃度的鹽酸將它們恰好中和,用去酸的體積V1=V2,
但NH3•H2O為弱堿,等pH時,其濃度大于NaOH,滴加等濃度的鹽酸將它們恰好中和,弱堿繼續電離產生氫氧根離子,則消耗酸多,即V3>V2,
所以消耗酸的體積關系為:V1=V2<V3,
故答案為:V1=V2<V3;
(3)(NH4)2A溶液是中性,說明NH4+和A2-離子水解程度相等,則一水合氨和H2A電離平衡常數相等,H2A溶液加入到Na2CO3溶液中有氣體放出,說明H2A酸性大于H2CO3,則CO32-水解程度大于NH4+,CO32-水解顯堿性,所以該溶液呈堿性,pH>7,
故答案為:>;
(4)氯化鐵水解呈酸性,Fe3++3H2O?Fe(OH)3+3H+,可使碳酸鈣溶解,反應的方程式為CaCO3+2H+=Ca2++H2O+CO2↑,反應消耗H+,使c(H+)減小,引起水解平衡向右移動,導致Fe(OH)3增多,溶液顏色變深或溶液為紅褐色或久置有紅褐色沉淀;在飽和氯化鐵溶液中加入一種單質,也會發生類似上述現象的反應,平衡正向進行,且加入的物質和酸反應放出氫氣,選項中AB是非金屬單質不能和酸反應,銅是金屬不能和稀酸反應,鎂和溶液中稀酸反應生成氫氣,促進平衡正向進行,生成氫氧化鐵紅褐色沉淀;
故答案為:有紅褐色沉淀生成,有氣泡生成;Fe3++3H2O?Fe(OH)3+3H+、CaCO3+2H+=Ca2++CO2↑+H2O; C;
(5)①當生成AgBr沉淀時,所需銀離子的濃度為:c(Ag+ )=$\frac{4.1×1{0}^{-15}}{0.1}$mol/L=4.1×10-14mol/l,
故答案為:4.1×10-14mo1/L;
②當生成AgCl沉淀時,所需銀離子的濃度為:c(Ag+ )=$\frac{Ksp}{c(C{l}^{-})}$=$\frac{1.6×1{0}^{-10}}{0.1}$mol/L=1.6×10-9mol/l,此時I-離子濃度為:c(I-)=$\frac{Ksp}{c(A{g}^{+})}$=$\frac{1.5×1{0}^{-16}}{1.6×1{0}^{-9}}$mol/L=9.375×10-8mol/l;
故答案為:9.375×10-8mol/l.
點評 本題考查了水的電離、鹽的水解原理及其應用、難溶電解質的溶解平衡及沉淀轉化的本質,題目難度中等,試題涉及的知識點較多、題量稍大,注意掌握pH的有關計算的方法,明確鹽的水解原理,掌握沉淀轉化本質及其應用方法.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
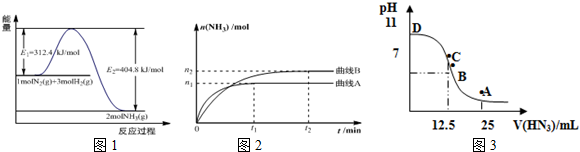
| 溫度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 裝置 | 現象 | 結論及解釋 |
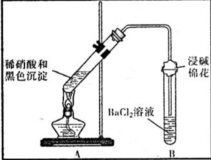 | ①A試管中黑色沉淀逐漸溶解 ②A試管上方出現紅棕色氣體 ③B試管中出現白色沉淀 | a.現象②說明褐色沉淀具有 還原性性. b.試管B中產生白色沉淀的總反應的離子方程式為 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
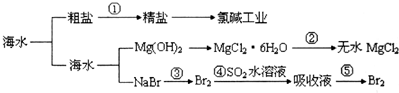
| A. | 第①步中除去粗鹽中的SO42-、Ca2+、Mg2+等雜質,加入的藥品順序為:Na2CO3溶液→NaOH溶液→BaCl2溶液→過濾后加鹽酸 | |
| B. | 工業上金屬鈉是通過氯堿工業制取的 | |
| C. | ④和⑤步的目的是為了濃縮 | |
| D. | 第③④⑤步中溴元素均被氧化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
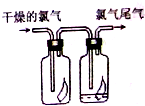 如圖所示,將氯氣依次通過盛有干燥有色布條的廣口瓶和盛有潮濕有色布條的廣口瓶,可觀察到右瓶的現象是:有色布條褪色,發生此現象的原因是Cl2+H2O?HCl+HClO.(用有關的方程式解釋)
如圖所示,將氯氣依次通過盛有干燥有色布條的廣口瓶和盛有潮濕有色布條的廣口瓶,可觀察到右瓶的現象是:有色布條褪色,發生此現象的原因是Cl2+H2O?HCl+HClO.(用有關的方程式解釋)查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com