
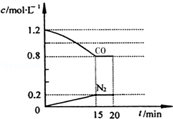
 回答下列問題:
回答下列問題:分析 (1)①根據v=$\frac{△c}{△t}$計算v(N2),根據n=△c×V計算生成N2的物質的量,根據方程式計算參加反應NO物質的量,進而計算NO的轉化率;
②A.縮小容器體積,壓強增大,平衡向正反應方向移動,移動結果不能消除CO濃度增大;
B.增加CO的量,CO的濃度增大;
C.降低溫度,平衡向正反應方向移動;
D.擴大容器體積,壓強減小,平衡向逆反應方向移動,平衡時CO濃度減小;
③改變起始投料量平衡時各物質體積分數仍然不變,說明與原平衡為等效平衡,正反應為氣體體積減小的反應,恒溫恒容下按化學計量數轉化到方程式左邊滿足同種物質投料量相等,即滿足n(NO)=2.0mol、n(CO)=2.4mol;
(2)Fe3+在溶液中水解顯酸性,通過增大H+濃度的方式抑制Fe3+水解;
(3)①根據題目信息“生成可以殺菌消毒的物質”可知一種產物為HClO,根據守恒的原則,另一種產物為NH3;
②只有Cl元素化合價發生變化,根據氯氣物質的量計算HCl物質的量,結合Cl元素化合價變化計算轉移電子.
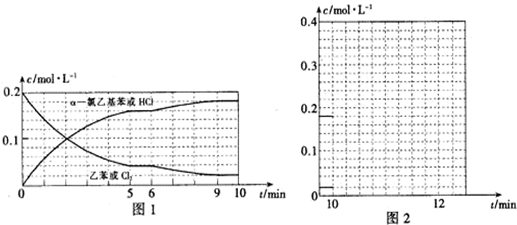
解答 解:(1)①由圖可知,15min N2的濃度變化量為0.2mol/L,則v(N2)=$\frac{0.2mol/L}{15min}$≈0.013mol/(L•min),生成氮氣為2L×0.2mol/L=0.4mol,則參加反應的NO為2×0.4mol=0.8mol,故NO的轉化率為:$\frac{0.8mol}{2mol}$×100%=40%,
故答案為:0.013mol/(L•min);40%;
②A縮小容器體積,壓強增大,平衡向正反應方向移動,移動結果不能消除CO濃度增大,平衡時CO濃度增大,故A錯誤;
B.增加CO的量,CO的濃度增大,故B錯誤;
C.降低溫度,平衡向正反應方向移動,CO濃度減小,故C正確;
D.擴大容器體積,壓強減小,平衡向逆反應方向移動,但平衡時CO濃度減小,故D正確;
故答案為:CD;
③A.與原平衡相比壓強增大,平衡正向移動,轉化率增大,平衡時各物質的體積分數發生變化,故A錯誤;
B.等效為起始投入2molNO、2.2molCO,與原平衡不是等效平衡,故B錯誤;
C.轉化到方程式左邊可以得到2molNO、2.4molCO,與原平衡為等效平衡,故C正確;
D.0.4mol CO、2.0mol CO2、1mol N2相當于n(NO)=2.0mol、n(CO)=2.4mol,與原平衡互為等效平衡,故D正確;
故答案為:CD;
(2)因為Fe3+存在水解平衡:Fe3++3H2O?Fe(OH)3+3H+,水解后溶液顯酸性,所以通過增大H+濃度的方式抑制Fe3+水解,
故答案為:氯化鐵溶液中存在如下平衡:Fe3++3H2O?Fe(OH)3+3H+,增大H+濃度,平衡逆向移動,抑制FeCl3水解;
(3)①根據題目信息“生成可以殺菌消毒的物質”可知一種產物為HClO,根據守恒的原則,另一種產物為NH3,方程式為:NH2Cl+H2O=HClO+NH3,
故答案為:NH2Cl+H2O=HClO+NH3;
②只有Cl元素化合價發生變化,化合價分別由0價變化為-1價、+1價,消耗氯氣的物質的量為0.5mol,生成HCl為0.5mol,則轉移電子0.5mol,
故答案為:0.5.
點評 本題考查較為綜合,涉及化學平衡計算與影響因素、化學反應速率的計算、等效平衡、鹽類水解、氧化還原反應等知識,是對學生綜合能力的考查,題目難度中等,注意熟練掌握化學平衡及其影響,試題充分考查了學生的分析能力及靈活應用能力.


 名師點撥卷系列答案
名師點撥卷系列答案 英才計劃期末調研系列答案
英才計劃期末調研系列答案科目:高中化學 來源: 題型:選擇題
| A. | v(A)=0.7mol•L-1•min-1 | B. | v (B)=0.3mol•L-1•min-1 | ||
| C. | v (C)=0.9mol•L-1•min-1 | D. | v (D)=0.8mol•L-1•s-1 |
查看答案和解析>>
科目:高中化學 來源:2017屆安徽省黃山市高三上月考二化學卷(解析版) 題型:選擇題
設NA為阿伏加德羅常數的值,下列敘述正確的是( )
A.常溫常壓下,22.4 L乙烯中C—H鍵數為4 NA
B.1 mol羥基中電子數為10 NA
C.在反應KIO3 + 6 HI = KI + 3 I2 + 3 H2O中,每生成3 mol I2轉移的電子數為6 NA
D.常溫下,1 L 0.1 mol·L-1 的NH4NO3溶液中氮原子數為0.2 NA
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學式 | H2(g) | CO(g) | CH3OH(l) |
| 標準燃燒熱(25℃) △H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 化學鍵 | C-H | C-C | C=C | H-H |
| 鍵能/kJ•mol-1 | 412 | 348 | x | 436 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 為防止電池中的重金屬污染土壤和水體,應積極開發廢舊電池的綜合回收利用 | |
| B. | 氫能是清潔能源,工業上電解水法制大量氫氣符合節能減排理念 | |
| C. | 大量的汽車尾氣是造成霧霾天氣的一個重要因素 | |
| D. | 煤的液化和氣化均屬于化學變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 時間/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s內用O2表示的平均速率為1.48×10-3 mol/(L•s) | |
| B. | T1溫度下的平衡常數為K1,T2溫度下的平衡常數為K2,若T1>T2,則K1<K2 | |
| C. | T1溫度下N2O5的平衡轉化率為50% | |
| D. | 平衡后其它條件不變,將容器的體積壓縮到原來的一半,則再平衡時c(N2O5)>5.00mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com